Studio dell’attività cerebrale mediante encefalografia con risonanza magnetica ultra veloce. I meccanismi della pulsazione glinfatica
Vesa Kiviniemi, Xindi Wang, Vesa Korhonen et al.
Journal of Cerebral Blood Flow & Metabolism 2016, Vol. 36(6) 1033– 1045
Articolo originale
Scarica l’articolo in formato pdf
Introduzione
Di recente il sistema di drenaggio linfatico del tessuto cerebrale, definito anche sistema glinfatico, è stato descritto come un flusso di convezione del liquor cefalorachidiano (cerebrospinal fluid, CSF) fra gli spazi periarteriosi e quelli perivenosi.
La forza trainante di questo flusso è stata parzialmente correlata alle pulsazioni indotte dal battito cardiaco e dal flusso sanguigno nelle arterie. Le pulsazioni arteriose spingono l’acqua e grazie alle acquaporine aiutano il trasporto dei soluti dagli spazi periarteriosi di Virchow-Robin verso il tessuto cerebrale extracellulare. A seguire le pulsazioni del flusso glinfatico migrano attraverso il tessuto cerebrale e scaricano i fluidi nello spazio perivenoso. Quest’ultimo dirige i prodotti di scarto dal cervello nel sistema linfatico.
Un recente studio ha dimostrato l’esistenza di normali vasi linfatici nelle membrane meningee, vasi che convogliano le scorie insieme al liquido cefalorachidiano defluito dal sistema glinfatico.
Iliff et al. ha dimostrato che l’energia propulsiva arteriosa guida in parte, il sistema glinfatico. Tuttavia le pulsazioni cardiache forniscono soltanto il 15-25% dell’energia propulsiva, di conseguenza devono esistere altri meccanismi di pulsazione che contribuiscono alla dinamica convettiva dei fluidi del CSF.
Le scansioni mediante risonanza magnetica funzionale (functional magnetic resonance imaging, fMRI) e altre tecniche hanno dimostrato che possono esserci diverse fonti di pulsazioni nel cervello. Lo spettro dei segnali BOLD con imaging pesato in suscettività magnetica (susceptibility-weighted blood oxygen level dependent, BOLD) mostra una forza pulsatile a frequenze molto basse (< 0,1 Hz) e frequenze respiratoria (0,2-0,3 Hz) e cardiaca (0,8-1,2 Hz) distinte.
In precedenza le varie pulsazioni erano considerate come un rumore che disturbava l’oggetto dello studio, e sono stati intrapresi tanti sforzi al fine di minimizzarne gli effetti. Le fluttuazioni del segnale BOLD < 0,1 Hz sono state correlate con la connettività funzionale delle reti neurali e con le onde vasomotorie. Tuttora risulta poco chiara una parte significativa delle interazioni e dei meccanismi di tali pulsazioni che influenzano il segnale cerebrale BOLD.
Una delle ragioni dell’incertezza sulle pulsazioni del segnale BOLD è la lentezza nella campionatura dei dati in studi realizzati sull’intero cervello mediante fMRI, con tempi di acquisizione di un volume cerebrale pari a 2-3s. Questo causa una distorsione delle pulsazioni (alised pulsations) da frequenze più veloci a quelle più lente.
Gli effetti dell’alising, combinati con quelli delle problematiche spin- history correlate al movimento, impediscono la diretta visualizzazione delle caratteristiche spazio-temporali delle pulsazioni nelle scansioni BOLD del cervello.
Recentemente è stato possibile scannerizzare l’intero cervello in 100 ms attraverso nuove tecniche 3D k-space di sottocampionamento ultra veloci come l’encefalografia con risonanza magnetica (magnetic resonance encephalography, MREG). Tale tecnica permette la rimozione dell’alising cardiorespiratorio, mentre le misurazioni in 3D escludono gli artefatti spin-history che solitamente si verificano nelle acquisizioni sequenziali in 2D a causa del movimento del bulkhead lungo le slice 2D. Pertanto la MREG con monitoraggio elettro- e cardiorespiratorio può registrare l’evoluzione temporale di tutte le pulsazioni fisiologiche con una copertura in 3D di tutto il cervello.
Nel presente studio è stato portato avanti uno sforzo di collaborazione per monitorare in modo esaustivo gli effetti spazio- temporali delle pulsazioni fisiologiche del tessuto cerebrale mediante la nuova tecnologia MREG ultra veloce e multimodale.
Tale tecnologia rimuove l’aliasing, minimizza gli effetti spin-history indotti dal movimento e offre una potenza statistica maggiore per l’analisi. La nostra ipotesi è che le onde vasomotorie a bassa frequenza non siano soltanto delle pulsazioni cardiorespiratorie con difetti di alising ma che formino un proprio schema spazio- temporale.
Illustriamo, per la prima volta, schemi distinti delle pulsazioni cardiache, respiratorie e vasomotorie e osserviamo come queste si propagano nel cervello umano. Vengono presentati e discussi nuovi risultati e idee riguardo la quantificazione delle pulsazioni fisiologiche nell’ottica del meccanismo glinfatico come modello primario della dinamica del flusso CSF durante lo stato di riposo.
Metodi
Sono stati sottoposti all’acquisizione di immagini 9 soggetti sani (25,67±4,52 anni).
I soggetti sono stati esaminati con l’utilizzo di uno scanner Siemens 3T SKYRA head coil a 32 canali.
I soggetti sono stati sottoposti all’acquisizione di immagini per 10 min. Sono stati così ottenuti 5822 volumi cerebrali 3D. Il t-pulse e l’optic pulse dello scanner per l’imaging a risonanza magnetica (magnetic resonance imaging, MRI) sono stati impiegati per sincronizzare tutti i segnali scannerizzati.
I dati respiratori sono stati acquisiti mediante la cintura di monitoraggio polmonare e respiratorio dello scanner al fine di differenziare le bande di frequenza correlate alla respirazione. Altri dati fisiologici sono stati ottenuti utilizzando un sistema di imaging sincrono e multimodale MRI compatibile e adatto per la camera di imaging di Skyra 3T.
Risultati
Effetto del polso cardiovascolare sul cervello – Card_map
In seguito all’arrivo dell’impulso cardiovascolare la diminuzione del segnale MREG si espande nei ventricoli e nelle aree attorno al quarto ventricolo nel tronco encefalico e nel cervelletto. Successivamente, a circa 7-800 ms, la variazione del segnale si propaga in modo centrifugo dal terzo ventricolo e dai ventricoli laterali ai gangli della base, al nucleo caudato, ai nuclei talamici e al cervelletto.
L’effetto dell’impulso cardiovascolare continua anche a 900 ms, diffondendosi dalle strutture periventricolari come la corteccia cingolata, verso la corteccia cerebrale e raggiungendo la massima diffusione intorno ai 1000 ms dopo la sistole.
L’impulso del segnale MREG cardiovascolare si espande dalle regioni dorsali in direzione delle aree frontali del cervello. Dopo aver raggiunto il bordo corticale la potenza della variazione del segnale MREG – correlata al ciclo cardiaco – si riduce continuando a diffondersi in tutta la corteccia cerebrale.
La diminuzione del segnale è seguita, sullo stesso percorso, da una variazione positiva di controbilanciamento del segnale MREG che si sviluppa in modo ciclico ad ogni battito cardiaco. Tale variazione inizia intorno ai 8-900 ms diffondendosi dalle regioni arteriose e diventando dominante nell’intera corteccia 1500 ms dopo il precedente battito cardiaco. Durante questo lasso di tempo il cuore ha già una nuova sistole e inizia un nuovo ciclo.
Effetto delle pulsazioni respiratorie sulla Resp_map
All’inizio dell’inspirazione gli effetti del ciclo respiratorio iniziano a propagarsi in modo centripeto nelle regioni cerebrali periferiche come segnale MREG positivo, si trasformano poi in segnale negativo nell’ultima metà del ciclo durante l’espirazione.
La variazione del segnale respiratorio, come l’effetto dell’impulso cardiovascolare, si diffonde dalla parte posteriore del cervello verso quella frontale. A differenza del ciclo cardiaco, qui le variazioni sono dominanti sia nell’area sottostante il seno sagittale, nella porzione frontale del cervello, sia nelle aree occipitali soprastanti il seno retto e il tentorio del cervelletto.
Gli effetti della respirazione sui dati MREG mostrano un ciclo di variazioni positive seguito da variazioni negative di controbilanciamento del segnale nella stessa direzione di propagazione spaziale. Dal punto di vista spaziale l’effetto respiratorio è chiaramente distinto rispetto all’effetto del ciclo cardiaco. Gli effetti spaziali del ciclo respiratorio sul segnale MREG appaiono più diffusi e globali nella corteccia cerebrale rispetto agli effetti cardiovascolari. Le ampiezze del segnale respiratorio risultano maggiori nella corteccia cerebrale rispetto agli effetti cardiovascolari.
Durante l’espirazione il segnale MREG risulta positivo nella sostanza bianca e nei ventricoli, presentando uno schema simmetrico nei due emisferi. Nella sostanza bianca la variazione del segnale MREG si presenta invertito rispetto alla maggior parte della corteccia.
Inoltre gli emisferi cerebellari esibiscono una variazione contraria del segnale MREG paragonata alla corteccia cerebrale.
Tuttavia le aree adiacenti al verme cerebellare e a entrambi i talami si presentano nella stessa fase della corteccia cerebrale. La variazione del segnale respiratorio nel cervelletto sembra ruotare sul piano sagittale e in senso orario, in modo simile alle variazioni cerebrali sagittali, poiché avanza verso la parte frontale.
Effetti delle onde vasomotorie Lf_map (0,027-0,073 Hz) e VLF_map (0,01-0,027 Hz)
Le onde LF sono più diffuse a livello spaziale e temporalmente più complesse rispetto alle pulsazioni cardiache periodiche. Le variazioni LF del segnale MREG iniziano principalmente nelle aree occipito- parietali e si espandono verso quelle frontali. Successivamente le onde LF inducono una variazione positiva del segnale MREG che coinvolge, in modo simmetrico, entrambi gli emisferi.
In particolare le onde LF, a differenza degli effetti cardiaci e respiratori, si propagano maggiormente nella sostanza bianca. Tali onde interessano uniformemente quasi l’intero cervello.
Le pulsazioni VLF possiedono una dinamica spazio-temporale più complessa. Inizialmente le onde VLF sono caratterizzate da un’onda negativa e mediana molto lenta che parte dalle aree frontali e si dirige verso la linea mediana posteriore nei primi 20-30s.
Al contrario di tutte le altre pulsazioni fisiologiche, l’onda VLF mostra poi una variazione positiva invertita, dalle regioni occipitali verso quelle frontali, che si colloca sotto l’iniziale onda negativa. Tutte le altre pulsazioni presentano un comportamento ciclico dove una variazione segue l’altra nella stessa direzione di rotazione della variazione precedente (Fig 5).
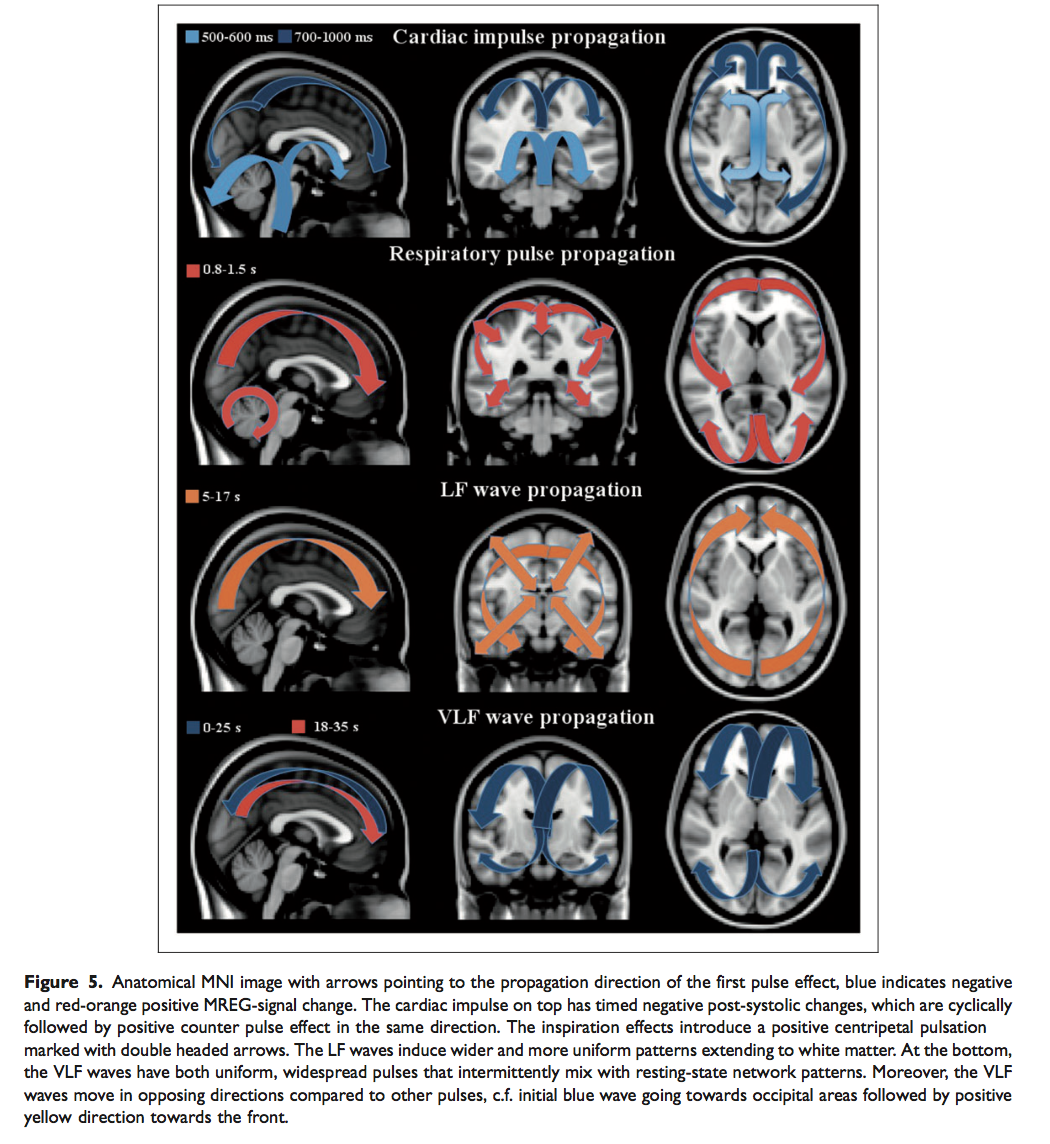
Discussione
La nostra analisi basata su imaging MREG ultra veloce dimostra che il cervello umano presenta alcune pulsazioni fisiologiche distinte. La pulsazione cardiovascolare induce un’impulso negativo e centrifugo del segnale MREG, seguito da una variazione positiva che riproduce lo stesso percorso verso la corteccia. Le variazioni del segnale indotte dalla respirazione dominano la corteccia lungo il sistema perivenoso di raccolta compiendo dei cicli centripeti verso il centro del cervello.
La terza tipologia di pulsazione del cervello sono le onde VLF e LF che a livello spazio-temporale presentano schemi differenti: le onde LF esibiscono schemi ripetitivi, omogenei e molto diffusi mentre le onde VLF sono caratterizzate da un andamento quasi-periodico con schemi complessi ripetutamente abbinate a onde diffuse.
A differenza di quanto affermato dagli studi precedenti le onde VLF/LF sono effettivamente dei fenomeni indipendenti, esenti dall’alising delle pulsazioni cardiorespiratorie inerente l’attività cardiaca veloce.
Le pulsazioni fisiologiche illustrate nella presente ricerca sono coerenti con la dinamica glinfatica del CSF nel cervello. Il sistema di drenaggio glinfatico può risultare disfunzionale nel suo compito di clearing dei rifiuti proteici nelle malattie neurodegenerative. Una piattaforma clinica in grado di valutare il meccanismo delle pulsazioni glinfatiche, come la MREG ultra veloce impiegata in questo studio, potrebbe aprire nuove prospettive di comprensione dei meccanismi patofisiologici alla base del deficit glinfatico e dell’accumulo di proteine durante l’invecchiamento.
L’impulso cardiovascolare cerebrale funge da spinta centrifuga per il CSF : la respirazione induce una variazione centripeta .
Il flusso venoso del cervello è governato da due meccanismi: le modulazioni della perfusione arteriosa e gli effetti della contropulsazione causati dalle alterazioni della pressione respiratoria nella cavità toracica. Le pulsazioni del segnale MREG, correlate al ritmo respiratorio, sono più lente e prive dell’inizializzazione arteriosa invertita presente nell’impulso cardiovascolare.
In effetti, la pulsazione respiratoria inizia nelle aree di drenaggio perivenoso nelle regioni corticali e si propaga in direzione centripeta verso il centro del cervello, ovvero l’opposto di ciò che accade con l’effetto dell’impulso cardiovascolare.
Poiché soltanto il 15-20% dell’energia propulsiva del sistema glinfatico deriva dalla pulsazione cardiovascolare i nostri risultati indicano che durante il ciclo respiratorio potrebbe esistere un meccanismo di contropulsazione a bassa pressione che spinge il fluido e può agire contro l’accumulo di scarti nelle aree perivenose. Essenzialmente l’efflusso del fluido glinfatico guida l’accumulo di prodotti di scarto nelle aree perivenose e, successivamente, fuori dal cervello.
Il deflusso venoso dal cervello, nel sistema di drenaggio venoso a bassa pressione, aumenta con l’inspirazione e diminuisce con l’espirazione. L’inspirazione riduce il volume ematico nelle vene, aumenta lo spazio perivenoso e fa spazio al deflusso glinfatico del CSF dal tessuto interstiziale. L’espirazione inverte questi effetti: la pressione intratoracica aumenta, le vene si distendono e gli spazi perivenosi si chiudono portando a una diminuzione del drenaggio del sistema glinfatico del CSF negli spazi perivenosi.
Inoltre, in linea con i nostri risultati, un’altro studio di imaging MRI ultra veloce e ad alta risoluzione suggerisce che la respirazione rappresenti una grande fonte per il flusso del CSF.
Le onde VLF/LF creano effetti spazio-temporali complessi e dinamici
Poiché la pressione della parete arteriosa influenza chiaramente la convezione del CSF nel cervello, anche le onde lente del tono vasomotorio, ossia la contrattilità delle cellule del tessuto muscolare liscio delle pareti dei vasi, influenzano la pulsazione glinfatica del CSF .
Le onde vasomotorie possiedono due distinti range di frequenza con un picco di potenza di scambio intorno a 0,03 Hz.
L’attività vasomotoria più lenta <0,03 Hz è correlata sia all’attività simpatica che a quella parasimpatica, mentre la componente più veloce è quasi esclusivamente collegata all’attività parasimpatica del controllo nervoso autonomo della circolazione cerebrale.
La LF sembra indurre variazioni globali uniformi nel cervello coinvolgendo maggiormente la sostanza bianca a differenza delle pulsazioni cardiorespiratorie. Le onde VLF presentano variazioni globali diffuse nel cervello insieme a schemi alternati di resting state e onde singole che viaggiano in direzioni opposte. Le fluttuazioni temporali delle onde LF e VLF sono più lineari nella corteccia cerebrale e più complesse nelle aree basali del CSF.
Le onde vasomotorie alterano il diametro delle arterie e dello spazio perivascolare modulando quindi la conduttanza elettrica dello spazio perivascolare tra quest’ultimo e l’interstizio. Inoltre si rende necessaria un’analisi multimodale approfondita delle fluttuazioni cerebrali VLF al fine di stabilirne l’origine e le potenziali funzioni negli esseri umani.
Conclusioni
Sulla base di nuove immagini cerebrali MREG ultra veloci presentiamo prove a supporto della coesistenza di tre distinti meccanismi di pulsazione del sistema glinfatico umano. Il meccanismo più veloce è quello della pulsazione cardiovascolare che origina negli spazi periarteriosi basali intorno al poligono di Willis e si estendono in modo centrifugo verso la corteccia cerebrale.
Il secondo meccanismo è la respirazione che si diffonde in modo centripeto e domina gli spazi perivenosi vicino alla corteccia.
In terzo luogo, le fluttuazioni delle onde vasomotorie sia in frequenza VLF che LF possiedono schemi spazio-temporali distinti. Abbiamo prodotto documentazione a supporto del fatto che le tre tipologie di pulsazioni possono essere separate utilizzando le tecniche MRI ultra veloci. La possibilità di registrare i meccanismi di pulsazione del sistema glinfatico potrebbe fornirci informazioni precoci sui meccanismi delle malattie neurodegenerative.

