Articolo originale: Stochkendah M.J., Christensen H.W., “Chest pain in focal musculoskeletal disorders”, Med Clin North Am 2010 (94):259–273.
Scarica la pagina in formato .pdf
In breve
Pur essendo una fonte di dolore toracico riconosciuto e frequente, il disturbo muscoloscheletrico localizzato è ancora poco conosciuto. Tuttavia, l’esigua quantità di ricerche disponibili indica che porre attenzione alle caratteristiche del dolore, ai fattori precipitanti, scatenanti ed allevianti, insieme ad una palpazione manuale sistematica della colonna vertebrale e della parete toracica può diagnosticare con successo un dolore toracico muscoloscheletrico localizzato. È possibile iniziare i trattamenti terapeutici conservativi adeguati, che comprendono la terapia manuale ed analgesici blandi per trattare la causa a volte invalidante dei disturbi.
Introduzione
Dato che il dolore toracico può avere cause benigne o potenzialmente letali, è fondamentale che l’approccio nella valutazione del paziente sia approfondito e strutturato. Una causa benigna del dolore è presente in circa l’80% dei casi, e di questi quasi il 50% è rappresentato da dolori muscoloscheletrici (1-3). Ad una minoranza consistente di pazienti il dolore toracico non viene mai diagnosticato con precisione né viene fatto un piano di follow-up. (4-7) Tuttavia, ben il 75% presenta sintomi persistenti o ricorrenti (8-9) e la mancanza di una diagnosi può portare a depressione (10), ansia (11) e una riduzione dell’attività quotidiana (8,10,12). Pertanto, è imperativo avere una conoscenza aggiornata degli approcci diagnostici nei confronti dei pazienti con dolore toracico, soprattutto in caso di dolore toracico muscoloscheletrico, per accelerare la diagnosi e fornire una gestione adeguata riducendo così l’ansia immotivata del paziente.
Tuttavia, può essere difficile giungere ad una diagnosi sicura di dolore toracico muscoloscheletrico perché non esistono standard di riferimento per verificare questa diagnosi. Il dolore toracico muscoloscheletrico è un termine ampio che comprende il dolore che proviene da svariate fonti osteomuscolari e con molti meccanismi di presentazione, tra i quali le origini traumatiche e non traumatiche, infiammatorie e non-infiammatorie, anche se i termini e le definizioni hanno la tendenza
a sovrapporsi (Riquadro 2).
Per tutte queste condizioni, ad eccezione della patologia degenerativa della colonna vertebrale, dell’artrite psoriasica, delle spondiloartropatie e delle fratture da stress, la diagnosi si basa essenzialmente sull’anamnesi e sugli esiti degli esami clinici per escludere altre patologie, piuttosto che per confermare la diagnosi. Il presente articolo si concentra sulle caratteristiche cliniche dei disturbi muscoloscheletrici localizzati più comunemente diagnosticati come cause di dolore toracico
muscoloscheletrico.
| Riquadro 2
Sottogruppi di dolore toracico muscoloscheletrico |
| Angina cervicotoracica Mialgia intercostale Disfunzione toracica segmentale Mialgia pettorale Disfunzioni costovertebrali Fibrosite Patologia degenerativa della colonna vertebrale Frattura da stress Angina cervicale Costocondrite Stretto toracico Sindrome di Tietze Sensibilità della parete toracica Fibromialgia Sindrome della parete toracica Malattia sternoclavicolare Scivolamento costale Spondiloartropatie sieronegative Miosite Artrite psoriasica |
Sindrome di TietzeLa sindrome di Tietze fu descritta per la prima volta nel 1921 dal chirurgo tedesco Alexander Tietze
La sindrome di Tietze colpisce persone più giovani di entrambi i sessi, con una predilezione per le coste superiori, in particolare la seconda e la terza giunzione costocondrale. Le lesioni sono unilaterali e singole nel 70%-80% dei casi. (35-37) Se multiple, le lesioni interessano solitamente le articolazioni vicine dello stesso lato. L’esordio può essere insidioso e possono presentarsi eritema e calore. È attualmente riconosciuto che nella sindrome di Tietze la presenza o l’assenza di gonfiore è solo un indicatore della gravità della patologia. Sebbene le cause reali della sindrome di Tietze non siano ben note, (35) spesso deriva da uno sforzo fisico o da lesioni di lieve entità, quali tosse eccessiva, vomito o impatti al torace (36). La diagnosi si basa su fondamenti clinici in seguito all’esclusione di altre patologie. Le indagini di routine non mostrano anormalità (36). Il dolore solitamente ha una durata limitata a settimane o mesi, ma in alcuni casi può diventare cronico (36). I trattamenti suggeriti constano della rassicurazione, l’applicazione locale di calore e l’uso di farmaci antinfiammatori non steroidei (FANS) (35-36).
CostocondriteLa costocondrite è un termine che viene usato in modo intercambiabile con la sindrome costosternale e la sindrome della parete toracica e le definizioni non sono coerenti (35,36,39). Tali sindromi sono tutte caratterizzate da dolore e sensibilità locale alle articolazioni costocondrali o condrosternali, o persino al processo xifoideo, ma senza l’infiammazione ed il gonfiore riscontrati nella sindrome di Tietze. Si tratta presumibilmente di una causa molto più comune di dolore toracico che colpisce ben il 30% delle persone che si presentano nei reparti d’urgenza (39). Nelle cure primarie, la costocondrite è stata riportata nel 42% dei pazienti con dolore toracico muscoloscheletrico (3). La patogenesi è poco conosciuta, ma in un sottogruppo di pazienti con costocondrite è stata riconosciuta una correlazione con le spondiloartropatie sieronegative e la costocondrite è stata vista come l’esordio iniziale di queste patologie (40). In altri, l’attività fisica ripetitiva è stata riportata come fattore precipitante (38). Il dolore può essere provocato a riposo, durante il movimento della gabbia toracica o con la respirazione (36). Il più delle volte presenta un decorso auto-limitato, ma le recidive sono comuni così come lo sono i casi cronici. Il trattamento comprende la rassicurazione; la terapia manuale ha dimostrato di essere utile in alcuni casi (42).
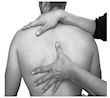
Sensibilità muscolareInsieme alla costocondrite, la sensibilità muscolare dei muscoli intercostali e pettorali può essere una delle cause più comuni di dolore toracico muscoloscheletrico. Nelle cure primarie, la sensibilità intercostale è stata segnalata come l’origine più comune di dolore, che comprende circa il 50% di tutti i pazienti con dolore toracico (2). La causa è da attribuire ad un’attività insolita o eccessiva, come ad esempio sollevare un peso, dipingere un soffitto, tagliare legna, tosse o sforzo di muscoli poco allenati. Anche uno stato di tensione o di ansia può produrre una tensione eccessiva. L’esordio può essere graduale improvviso. I pazienti riferiranno dolore localizzato e sensibilità sopra i muscoli tesi. Il dolore è aggravato da manovre che tendono o allungano i muscoli (35). La valutazione della sensibilità muscolare si fa mediante palpazione manuale (Fig. 1 e 2). Per quanto di nostra conoscenza, solo uno studio ha valutato l’affidabilità della palpazione per la sensibilità della parete toracica trovando una grande differenza tra gli esaminatori quando la palpazione aveva lo scopo d’indagare sulla sensibilità (27). |
| Fig. 1. Palpazione manuale della parete toracica anteriore mediante contatto delicato con l’indice o il medio e con l’operatore posizionato dietro il paziente. |
|
|
| Fig. 2. Potenziali punti di sensibilità sulla parete toracica anteriore. I punti pettorali maggiori sono situati presso le linee ascellari anteriori a 3 cm in direzione caudale alle clavicole (punti 1 e 8). I punti pettorali minori si trovano presso le linee medioclavicolari in direzione appena caudale alle clavicole (punti 2 e 9). I muscoli intercostali sono palpati lateralmente allo sterno presso lo spazio intercostale tra II/III e VI/VII (punti 3-7 e 10-14). |
|
|
Disfunzione segmentale del collo e della colonna vertebrale toracicaAvendo origine nella parte posteriore della parete toracica o del collo, la disfunzione segmentale della colonna vertebrale è forse una delle cause più sotto-diagnosticate di dolore toracico muscoloscheletrico (43). Il termine ”disfunzione segmentale” si riferisce ad un disturbo della funzionalità che colpisce la qualità ed il range di movimento dei segmenti spinali senza che vi siano alterazioni strutturali. La definizione racchiude disturbi della funzionalità che possono essere rappresentati da una diminuzione o anomalia del movimento (44). La disfunzione segmentale del rachide cervicale inferiore (da C4 a C7) e della colonna vertebrale toracica superiore (da T1 a T8) può causare dolore riferito alle zone anteriori della parete toracica (27-45). Ciò è dovuto al fatto che i segmenti spinali disfunzionali tendono a produrre dolore in una zona corrispondente alla distribuzione dell’innervazione segmentale delle strutture profonde. (46) La disfunzione segmentale può essere presente con o senza patologie degenerative della colonna vertebrale. È stato valutato che la disfunzione segmentale è presente nel 14% dei pazienti con dolore toracico muscoloscheletrico (5) e nel 29% di tutti i pazienti presentatisi con dolore toracico acuto per sospetto infarto miocardico acuto (26). In una popolazione di pazienti con dolore toracico cronico ricoverata per angiografia coronarica in un reparto di cardiologia, al 18% è stata riscontrata una sindrome clinica di dolore toracico originato dalla colonna cervicotoracica e dal torace, chiamata angina cervicotoracica (CTA) (27).
Lo studio clinico prospettico dei pazienti con dolore toracico cronico effettuato da Christensen e colleghi (27) è stato in grado di stabilire alcune caratteristiche cliniche che potrebbero differenziare i pazienti con CTA da quelli senza (Riquadro 3). Il dolore trafittivo è presente con frequenza simile nei 2 gruppi, anche se più frequente nei pazienti positivi alla CTA, che hanno inoltre manifestato i sintomi per un tempo più breve e con episodi meno frequenti. L’attività fisica che provoca dolore era significativamente meno frequente nel gruppo dei CTA-positivi; essi hanno sofferto più spesso di dolore auto-riferito al collo, dolore alla colonna vertebrale toracica e dolore spalla-braccio (27). |
|
|
| Riquadro 3
Caratteristiche cliniche con differenze significative di frequenza tra pazienti CTA-positivi e CTA-negativi con dolore toracico cronico |
| È più probabile che i pazienti CTA-positivi abbiano:
Dolore trafittivo È più probabile che i pazienti CTA-negativi abbiano: Episodi più frequenti di dolore |
| Dati tratti da Christensen HW, Vach W, Gichangi A, et al. Cervicothoracic angina identified by case history and palpation findings in patients with stable angina pectoris. J Manipulative Physiol Ther 2005;28:303-11. |
|
|
| Fig. 3. Modelli di dolore riferito da strutture somatiche profonde dei segmenti spinali toracici e lombari basati sugli esperimenti di Kellgren et al (46) e di Feinstein et al (67) in cui le strutture spinali e paraspinali sono state iniettate con soluzione salina ipertonica. (Da Dvorak J, Dvorak V. Manual medicine diagnostics. Stuttgart (NY): Georg Thieme Verlag; 1990; previa autorizzazione.) |
|
|
| È stato segnalato che il dolore causato da disfunzione segmentale è peggiore a riposo o dopo una posizione seduta prolungata e con rotazione spinale (43, 50), ma il forte dolore a riposo è stato segnalato soltanto in un terzo circa dei pazienti con dolore toracico cronico e non sembra essere un fattore discriminante (27). A differenza della cardiopatia ischemica, l’attività può alleviare il dolore (43). La sensibilità muscolare paraspinale è spesso presente a livello della disfunzione delle articolazioni spinali (50). a volte il dolore può essere riprodotto tramite la palpazione delle articolazioni spinali e delle strutture correlate (Fig. 4) (43). Lo sforzo eccessivo (acuto o ripetuto) a tale livello in seguito a trauma, sforzo o movimento falso può portare all’attivazione anomala delle strutture nocicettive (43).
I vantaggi del trattamento manipolativo spinale (SMT) sono stati valutati in studi clinici non randomizzati confrontando pazienti con CTA trattati con SMT con pazienti non trattati senza CTA (51). Circa il 75% dei pazienti con CTA ha riferito un miglioramento nel dolore e nella salute generale dopo il trattamento, rispetto ad una minore proporzione statisticamente significativa del 22% e del 25% dei pazienti senza CTA.
Angina cervicaleL’angina cervicale è stata definita come un dolore al petto che assomiglia ad una vera angina cardiaca, ma proviene da una discopatia cervicale con compressione della radice del nervo (52). L’angina cervicale è stata descritta da diversi ricercatori negli ultimi 70 anni (53-58). I pazienti con angina cervicale possono essere considerati come la fase finale della progressione di una patologia in cui le alterazioni degenerative della colonna vertebrale hanno portato alla discopatia. A differenza della maggior parte delle altre sindromi da dolore toracico muscoloscheletrico localizzato, la diagnosi può essere confermata mediante risonanza magnetica o risultati radiografici. |
|
|
| Fig. 4. Palpazione manuale del movimento della colonna toracica. Il paziente è guidato dal medico attraverso movimenti di rotazione e/o side-bending, spingendo delicatamente l’avambraccio della mano indifferente dell’operatore. Alla fine del range di movimento, la mano con cui l’operatore sta eseguendo la palpazione applica delicatamente della forza supplementare sopra le articolazioni spinali per valutare il movimento articolare. |
|
|
Slipping costaleLa sindrome da scivolamento costale, è una forma di dolore meccanico della costa meno conosciuta che rappresenta circa il 5% dei casi di dolore toracico muscoloscheletrico nelle cure primarie (3, 35, 36). Lo scivolamento costale è attribuito all’allentamento dei legamenti fibrosi che collegano le cartilagini delle coste inferiori tra loro, il che permette alla testa della costa di arricciarsi verso l’alto e sovrapporsi alla parte inferiore della costola sovrastante, causando una pressione sul nervo intercostale. È molto probabile che tale disturbo sia d’origine traumatica, dato che molti pazienti ricordano infortuni passati a livello del lato interessato. L’esordio è insidioso, con dolore unilaterale intermittente nel margine inferiore della gabbia toracica. A volte si può sentire un click doloroso sopra la punta della cartilagine costale coinvolta in alcuni movimenti. La cartilagine costale coinvolta è soffice e, alla palpazione, si muove più liberamente del normale. La remissione è lenta e il dolore può durare per diversi mesi. Le terapie benefiche includono la rassicurazione e degli analgesici blandi.
Meccanismi del dolore toracico viscerale e somaticoIn linea di massima, il dolore toracico può essere classificato come d’origine viscerale o somatica. Il dolore viscerale include il dolore da strutture tra cui il cuore, l’esofago, lo stomaco e così via, mentre il dolore somatico comprende dolori da strutture osteomuscolari, tessuti dermici e rivestimenti degli organi principali. La profondità del tessuto nel dolore somatico tende a stabilire se è somatico superficiale (pelle, guaine tendinee, periostio, fasce superficiali) o somatico profondo (muscolo, fasce, tendini, capsule, legamenti, periostio) (59). Usando il dolore cardiaco come esempio dei meccanismi del dolore viscerale, il dolore cardiaco è trasmesso da fibre nervose simpatiche e da fibre del nervo vago (59). Questo tipo di dolore viscerale è mediato da terminazioni nervose libere che hanno recettori situati nella mucosa, nei muscoli e nelle sierose del cuore e possono essere stimolati chimicamente o meccanicamente (60, 62). I nervi simpatici hanno corpi cellulari nei gangli delle radici dorsali e sinapsi sugli interneuroni nel corno dorsale del midollo spinale. Gli interneuroni che ricevono il dolore viscerale sono chiamati neuroni viscero-somatici e ricevono anche input somatici afferenti dalla pelle, dai tendini e dai muscoli. Il dolore viscerale di origine cardiaca viene trasmesso tramite i 4-5 segmenti spinali toracici superiori, nonché alcuni segmenti cervicali. Tuttavia, gli impulsi sensoriali dai visceri del torace e della parete (muscoli, pelle, articolazioni) condividono gli stessi segmenti spinali, rendendo difficile in alcuni casi la differenziazione delle cause e la diagnosi del dolore toracico (63, 64). La convergenza di fibre del dolore somatico e viscerale sugli stessi interneuroni del midollo spinale potrebbe spiegare perché il dolore viscerale è spesso indicato, o meglio, perché è spesso percepito in aree somatiche lontane dall’organo coinvolto. Pertanto, il dolore derivante da organi diversi, quali la parete toracica, l’esofago o il cuore, può essere indistinguibile perché il dolore potrebbe derivare anche dalla colonna dorsale (64). Le vie ascendenti al cervello si proiettano attraverso il sistema anterolaterale della colonna vertebrale al midollo, al mesencefalo ed al talamo. Nel midollo, le vie del dolore viscerale interagiscono con la formazione reticolare, mediando l’attivazione e le risposte autonomiche al dolore. Nel mesencefalo, le proiezioni alla sostanza grigia periacqueduttale sono importanti per la discesa della modulazione. Dal talamo, l’input di dolore viscerale viene inoltrato alle aree della corteccia, come dimostrato nell’uomo utilizzando la tomografia a emissione di positroni, dove viene decodificato come una sensazione dolorosa (65). I nocicettori sono sensibili a stimoli che sono potenzialmente nocivi come stimoli meccanici, chimici e sensibilizzati da una grande varietà di meccanismi che ne possono abbassare la soglia e dare la possibilità agli stimoli non nocicettivi di essere registrati come stimoli che producono dolore. Gli impulsi del dolore sono mediati da fibre nervose afferenti che collegano il nocicettore periferico al midollo spinale. Le fibre afferenti primarie s’immettono nel corno dorsale del midollo spinale e interagiscono a mezzo di sinapsi con i neuroni di secondo ordine (66). Le vie ascendenti sono state descritte in precedenza. Diverse strutture osteomuscolari della regione spinale sono state studiate utilizzando soluzioni irritanti per iniezione. Kellgren (46) ha delineato la distribuzione del dolore dai legamenti, che era diversa dai ben noti dermatomi. Ha scoperto che la fascia, il periostio e i tendini danno luogo dolore a distribuzione segmentale. Feinstein (67) ha studiato la distribuzione del dolore e la sensibilità quando il legamento interspinoso è irritato (Fig. 3). Diversi segmenti spinali danno un dolore riferito alla parete toracica anteriore. Inoltre, le articolazioni zigoapofisarie toraciche nei segmenti da T3 a T9 possono causare intense aree di dolore a livello di un segmento inferiore e leggermente laterale rispetto all’articolazione disfunzionale ,con irradiazione verso la parete toracica anteriore (68). Non esistono studi più recenti e approfonditi sui modelli di dolore riferito di carattere muscoloscheletrico.
Metodi diagnosticiIl fondamento della diagnosi è la palpazione manuale del dolore e del movimento dei muscoli e delle articolazioni della parete toracica e della colonna cervicotoracica. Pertanto, la sindrome è difficile da diagnosticare e passibile di variazione a seconda dell’osservatore. La variazione inter-osservatore della palpazione manuale della colonna vertebrale è stata valutata diverse volte (69-70). I risultati indicano che, anche se c’è un alto grado di variabilità inter-osservatore nella palpazione del movimento spinale e della sensibilità muscolare anteriore della parete toracica (71), il grado di variabilità è di un livello clinicamente accettabile (69-72). Il problema della verifica della diagnosi clinica, soprattutto del movimento spinale e del dolore, senza standard di riferimento, è stato affrontato attraverso varie misure indirette (73-77). I risultati confermano la validità della palpazione nella rilevazione della disfunzione segmentale spinale.
|
Bibliografia1. Klinkman MS, Stevens D, Gorenflo DW. Episodes of care for chest pain: a preliminary report from 8. Chambers J, Bass C. Chest pain with normal coronary anatomy: a review of natural history and 16. Klocke FJ, Baird MG, Lorell BH, et al. ACC/AHA/ASNC guidelines for the clinical use of cardiac 20. Leboeuf-Yde C, Nielsen J, Kyvik KO, et al. Pain in the lumbar, thoracic or cervical regions: do age and gender matter? A population-based study of 34,902 Danish twins 20–71 years of age. BMC 26. Bechgaard P. [Segmentally thoracic pain in patients admitted to a coronary care unit]. Ugeskr 35. Fam AG, Smythe HA. Musculoskeletal chest wall pain. CMAJ 1985;133:379–89. 42. Rabey MI. Costochondritis: are the symptoms and signs due to neurogenic inflammation. Two 58. Booth RE, Rothstein RD. Cervical angina. Spine 1976;1(1):28–32. 66. Harford WV. Southwestern internal medicine conference: the syndrome of angina pectoris: role of visceral pain perception. Am J Med Sci 1994;307:305–15. |