L’intervento osteopatico nel riequilibrio dell’asse dello stress
di Nicola Barsotti D.O.
scarica l’articolo in formato pdf
Qualsiasi intervento manipolativo osteopatico, che l’operatore ne sia consapevole o meno, agisce sul riequilibrio dell’asse dello stress (HPA) e sui meccanismi di comunicazione e di regolazione sistemica.
Prima di entrare nel merito di come l’osteopata modula tali meccanismi, è necessario spiegare il meccanismo con il quale gli stressor attivano i grandi circuiti regolatori: nervoso, endocrino e immunitario.
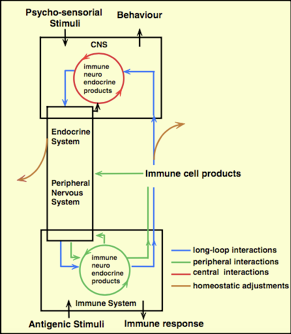
Fig.1
Secondo quanto riportato da Besedovsky, presidente della Società Internazionale per la Neuroimmunomodulazione (ISNIM), uno stressor emozionale è in grado di stimolare il SNC (Fig. 1). Da qui, le cellule del sistema nervoso, endocrino e immunitario rilasciano molecole (citochine, ormoni, neurotrasmettitori, etc…) che stimolano alla periferia sia il sistema endocrino che tutto il sistema nervoso periferico (SNP). A loro volta, questi due sistemi, liberano molecole in grado di influenzare tutto il sistema immunitario. Come conseguenza, alla periferia del corpo, il sistema nervoso rilascia molecole che in parte andranno a retroagire sul sistema endocrino e sul SNP regolandone le funzioni e, in parte, raggiungeranno il SNC per modulare i circuiti neurologici in modo tale da avere la reazione più adatta allo stimolo emozionale.
Lo stesso circuito, comunque, si attiva in tutta la sua complessità anche davanti ad uno stimolo antigenico per avere la miglior risposta immunitaria possibile (Besedovsky H. O. and del Rey A. 2007).
L’osteopata, rispettando uno dei paradigmi fondamentali della propria disciplina (la relazione tra struttura e funzione), influenza questo complesso network attraverso la fascia.
In essa, infatti, troviamo tutto il sistema recettoriale (Schleip 2003; Stecco 2010; Stecco 2012). Di conseguenza, attraverso il tocco, l’osteopata influenza il SNP, trovando così la via di accesso per influire sul circuito abilmente sintetizzato da Besedovsky nella figura appena descritta. Che l’osteopata agisca sul sistema nervoso lo sappiamo proprio grazie ad un lavoro italiano guidato da Cerritelli. Dai dati della ricerca è emerso che il trattamento manipolativo osteopatico (OMT) è in grado di modulare il sistema nervoso autonomo (SNA), stimolando l’attività parasimpaticotonica, con conseguente effetto anti-infiammatorio e anti-dolorifico (Ruffini et al. 2015).
Oltre a ciò sappiamo che l’OMT stimola (Schleip 2003):
- I corpuscoli del Pacini che sono sensibili alle variazioni rapide e alla vibrazione e che verosimilmente reagiscono a thrust e tecniche vibratorie.
- Gli organi del Ruffini, che rispondono agli impulsi lenti e alle pressioni prolungate. Si attiverebbero in tecniche profonde mantenute nel tempo, applicate sui tessuti molli che determinano una riduzione dell’attività del S.N.S., spiegando il profondo effetto rilassante di queste tecniche.
- Le terminazioni nervose libere (FNE) o recettori muscolari interstiziali. Rispondono alla pressione e alla tensione meccanica.
Grazie a questo importante effetto stimolatorio sul sistema nervoso, l’OMT influenza il sistema immunitario. Esistono infatti cinque vie principali di comunicazione neuro-immunitaria:
- Neuro-ormonale: l’attivazione dell’asse HPA porta al rilascio di cortisolo e catecolamine che stimolano direttamente le cellule immunitarie a rilasciare citochine pro-infiammatorie (Bottaccioli 2005).
- Vagale (Cholinergic antinflammatory pathway): il nervo vago, oltre ad essere il nervo principale per la regolazione parasimpatica dell’organismo, è anche il più potente sistema antinfiammatorio naturale che possediamo. Le sue terminazioni periferiche sono in grado di percepire la presenza di citochine proinfiammatorie nei tessuti, portare l’informazione al nucleo afferente del vago (nucleo del tratto solitario) e, tramite l’attivazione dei nuclei efferenti vagali (nucleo ambiguo e nucleo dorsale del vago), far sì che questo straordinario nervo rilasci acetilcolina nel tessuto infiammato. L’effetto di questa molecola in periferia è di inibire il rilascio delle citochine proinfiammatorie da parte del sistema immunitario (effetto antinfiammatorio) (Tracey 2007).
- Sinapsi neuro-immunitarie: nel 1984 si è scoperto che le fibre ortosimpatiche innervano tutti gli organi linfoidi (primari e secondari). Una iper-ortosimpaticotonia (tipico effetto conseguente all’attivazione dell’asse dello stress) quindi, stimola la maturazione e il rilascio di cellule immunitarie (Felten et al. 1984).
- Comunicazione tra S.N. somatico e sistema immunitario: a cavallo tra il XX e il XXI secolo si è scoperto che anche le terminazioni nervose somatiche, tramite il rilascio di neurotrasmettitori e altre molecole, è in grado di influenzare direttamente le funzioni del sistema immunitario alla periferia (infiammazione neurogena, ossia uno stato infiammatorio locale nei tessuti periferici causato dall’attività neuronale. In altri termini, si tratta dell’azione “orchestrata” di cellule immunitarie, vascolari e neurali) (D’Alessandro et al. 2016).
- Bottom-up immunitario: le citochine rilasciate dal sistema immunitario alla periferia possono influenzare direttamente il SNC tramite due vie: umorale e nervosa. Nel primo caso queste molecole, per via circolatoria, stimolano gli organi circumventricolari, privi di barriera ematoencefalica (BBB) e le altre aree cerebrali tramite complessi meccanismi di superamento della BBB. Nel secondo caso utilizzano i meccanismi già descritti con il nervo vago (Bottaccioli 2014).
La stimolazione del sistema immunitario, come conseguenza, influenza gli assi neuro-endocrini. Ad esempio, il rilascio di IL-1 alla periferia da parte delle cellule immunitarie, tramite la circolazione, stimola direttamente l’ipotalamo. Ne consegue che alcuni assi vengono iperstimolati: asse HPA, asse ipotalamo-ipofisi-GH, asse ipotalamo-ipofisi-prolattina. Altri assi, invece, vengono ipoattivati: asse ipotalamo-gonadi, asse ipotalamo-tiroide (Bottaccioli 2008).
Per sottolineare la complessità delle relazioni tra i vari sistemi, possiamo fare un esempio: l’ormone della prolattina è in grado di stimolare direttamente ogni cellula del sistema immunitario (Costanza et al. 2014). Ne consegue che una iperprolattinemia può essere causa di sviluppo di patologie autoimmuni molto differenti tra loro, come l’artrite reumatoide, il LES, la sclerosi multipla, la tiroidite di Hashimoto, il morbo di Addison, etc… (De Bellis et al. 2005). Se allarghiamo il discorso e pensiamo che ogni singolo ormone o neurotrasmettitore è in grado di modulare l’attività delle cellule immunitarie, possiamo capire quanto sia riduttivo un approccio terapeutico basato sull’illusoria relazione di causa-effetto. In campo farmacologico lo vediamo continuamente attraverso la somministrazione di farmaci che agiscono solo sull’effetto di un problema; in campo manipolativo lo vediamo quando, ad esempio, pensiamo di influenzare direttamente l’attività cardiaca con un trust sulla quarta vertebra dorsale pensando di stimolare solo il sistema nervoso.
Come conclusione della prima parte, pertanto, possiamo dire che l’osteopatia, attraverso la fascia e la stimolazione del SNA, è in grado di influenzare i meccanismi biologici di comunicazione appena descritti.
Oltre a ciò, però, bisogna aggiungere che il sistema nervoso simpatico, che come sappiamo si iperattiva sotto stress, è anche in grado di aumentare la tonicità fasciale. Per anni i ricercatori hanno cercato di trovare il link diretto tra iper-ortosimpaticotonia e aumento della tensione della fascia senza successo (Schleip and Jager 2012). La scoperta è avvenuta nel 2009 grazie ad un gruppo di ricercatori in campo PNEI (Bhowmick et al. 2009). Sono stati loro, infatti, a scoprire che le fibre ortosimpatiche, tramite il rilascio di TGF-β1, creano un abbassamento del pH tissutale con conseguente aumento della contrazione dei miofibroblasti (Schleip et al. 2006).
Tutto questo, ovviamente, crea un circolo vizioso: l’aumento della tonicità fasciale stimola le terminazioni nervose del SNA che, a loro volta, aumentano il rilascio di TGF-β1 (Bhowmick et al. 2009).
La conseguenza di un aumento del tono della fascia ha effetti potenzialmente devastanti nella fisiologia del corpo. A spiegarci ciò che succede è un nuovo settore della biologia: la meccano-biologia. Infatti, grazie a questo recente filone di ricerca, si è visto come la tensione della matrice extracellulare (ECM) sia in grado di modificare il funzionamento e l’espressione genica delle cellule ad essa collegate (Jacobs et al. 2013). Vediamo di chiarire meglio come ciò avviene osservando prima i link meccanici e poi gli effetti biologici di tali connessioni.
Nella visione “classica”, la cellula è vista come una “sacca” contenente organuli all’interno di un metaplasma con cui non ha legami fisici. Nella nuova visione, invece, la cellula è strutturalmente collegata con la MEC. Andando dall’esterno verso l’interno vediamo che la MEC si collega a particolari proteine di membrana chiamate integrine. Queste, a loro volta, internamente, sono collegate con il citoscheletro della cellula che, a sua volta, più internamente, è in diretto contatto con la membrana nucleare. Qui, grazie ad alcune proteine-ponte (KASH-SUN), il citoscheletro comunica con la cromatina (Tadeo et al. 2014).
Ne consegue che qualsiasi stimolo meccanico a cui viene sottoposta la MEC (ad esempio attraverso la ginnastica, una camminata, la peristalsi degli organi e, ovviamente, le manipolazioni), arriva direttamente a modulare l’espressione genica. In altre parole, grazie a queste connessioni strutturali, manipolando la fascia abbiamo una stimolazione epigenetica (Jacobs et al. 2013).
Ma c’è di più. Quando l’integrina viene stimolata dalla trazione della MEC, libera all’interno della cellula stessa delle particolari molecole che andranno direttamente dentro il nucleo e moduleranno la trascrizione genica. Esiste quindi una trasformazione del segnale: da meccanico a chimico e, non a caso, il processo è stato battezzato “trasduzione meccano-chimica” (Ingber 2003).
La scoperta delle proprietà meccaniche nel campo della biologia sta completamente trasformando la ricerca in campo medico in ogni settore, dalla pediatria alla pneumologia, dalla cardiologia all’oncologia, etc…
Un esempio interessante legato alle reazioni fisiologiche date da cambiamenti morfo-tenso-strutturali, riguarda il rilascio delle prostaglandine (PGE) che entrano in gioco nei processi infiammatori (i FANS, non a caso, inibiscono il rilascio di queste molecole). Si è visto, infatti, che se la MEC è eccessivamente tesa, la cellula tende a produrre quantità maggiori di prostaglandine (Reilly et al. 2003).
Questo quindi spiega perché le tecniche manipolative fasciali, ripristinando una giusta ed equilibrata tensione, riducono l’infiammazione tissutale. Riguardo l’efficacia della manipolazione, inoltre, sappiamo che la sostanza fondamentale è termosensibile e, quindi, se sottoposta a calore, diventa più fluida (lo stress meccanico su precisi punti della fascia aumenta la temperatura della sostanza fondamentale, facilitando il passaggio da gel a sol) (Stecco and Stecco 2010).
Chiaramente conosciamo ancora poco riguardo gli effetti di regolazione locale e sistemica dati dalla manipolazione fasciale, soprattutto sulle modificazioni epigenetiche.
È però molto interessante quanto ci dice Minasny sugli effetti del “Fascial Unwinding” (svolgimento fasciale). Attraverso la stimolazione dei recettori interstiziali abbiamo sia effetti locali che sistemici. Localmente vi è una riduzione del tono muscolare, una vasodilatazione locale, una minor viscosità tissutale, una riduzione del tono dei miofibroblasti. A livello sistemico, invece, abbiamo un aumento del tono vagale (con conseguente effetto anti-infiammatorio e anti-dolorifico) e una maggior calma mentale (riduzione dello stress) (Minasny 2009).
Il cambiamento locale del tessuto avviene anche grazie alla stimolazione delle terminazioni interocettive che seguono vie nervose totalmente differenti da quelle propriocettive (lamina I-spino-talamo-corticale dove raggiungono l’insula). Infatti alla periferia, sotto le nostre mani, ci accorgiamo di aver stimolato gli interocettori in modo efficace quando avvertiamo un aumento dell’idratazione della ECM tramite un maggior afflusso di plasma extravasale (Schleip 2003).
Oltre a ciò, è necessario porre attenzione alle risposte vegetative (ed emozionali) che possono verificarsi tramite queste vie. Non è un caso che spesso i pazienti riferiscono sensazioni riguardanti la leggerezza o la pesantezza, il calore, o un senso di generale benessere, ed è fondamentale che l’osteopata si accorga della controparte fisica di tali vissuti: cambiamenti nell’idratazione locale, nella temperatura, nel colore della pelle, nel ritmo del respiro e dei micromovimenti degli arti, nella dilatazione delle pupille e nelle espressioni facciali (Schleip and Jager 2012).
Come ulteriore conseguenza, data dalla stimolazione degli interocettori, possono emergere risposte psico-emozionali a seguito di cambiamenti della percezione interna del corpo (Ibidem). In particolare, le tecniche viscerali attivano in modo significativo le vie interocettive, con significativi effetti fisiologici ed emozionali. Se prendiamo ad esempio disturbi complessi come la sindrome del colon irritabile vediamo che questi sono associati ad un’alterazione della risposta dell’insula allo stimolo viscerale (Paulus and Stein 2010). È quindi plausibile che un tocco lento e delicato possa essere utile, se non addirittura ideale, come approccio per la regolazione o interocettiva (Schleip and Jager 2012).
È fondamentale inoltre sottolineare che la lamina I è l’unica zona, oltre ai nuclei motori del SNA, a ricevere sinapsi discendenti dal nucleo ipotalamico paraventricolare, cioè da quel nucleo che attiva l’asse dello stress (Hall 2011).
Questa osservazione è centrale per la nostra discussione: attraverso la fascia abbiamo una via di comunicazione diretta per la regolazione dell’asse HPA.
È chiaro quindi, in base a quanto abbiamo appena detto, che l’osteopatia, attraverso un riequilibrio neuro-miofasciale, è in grado di innalzare sia le capacità propriocettive che interocettive, con conseguente miglioramento dello “schema corporeo” e dell’“immagine corporea” (Hart S. et al.2001; Serino and Haggard 2010). Tutto questo permette di avere una maggior consapevolezza del corpo, dei sentimenti viscerali e delle emozioni, in relazione all’organismo e all’ambiente esterno (Critchley 2005).
Non solo: grazie ad un nuovo settore di ricerca fondato dal grande Francisco Varela, l’Embodied Cognitive Science (Scienza Cognitiva Incarnata), possiamo trovare nuovo razionale in grado di spiegare i molteplici effetti di regolazione sistemica della terapia osteopatica.
Secondo questo approccio la psiche può essere compresa solo se si considera il suo rapporto con le capacità sensoriali e di reazione motoria dell’organismo: essa non esiste infatti nel vuoto e, ammesso e non concesso che sia confinata nel cervello, quest’organo non è isolato, ma si trova in strettissima relazione con il resto del corpo.
La mente, quindi, emerge dalla fisiologia dell’organismo (è “incarnata”) e dalle interazioni che una persona ha con le altre persone e l’ambiente in cui vive (è “relazionale”) (Gallagher and Zahavi 2008). Non è un caso che all’interno delle connessioni cortico-baso-talamo-corticali (rientrano nei circuiti propriocettivi), oltre a trovare circuiti di tipo motorio, troviamo anche circuiti di tipo esecutivo-associativo e, soprattutto, emozionale (Squire et al. 2013).
Proviamo però ad allargare un pò lo sguardo. Fino ad ora abbiamo visto l’effetto di un tocco “tecnico”, terapeutico, effettuato da un osteopata. Ma il “tocco”, come quello esercitato da una madre sul proprio figlio, che cos’è? Riesce comunque a produrre degli effetti fisiologici nel corpo? La risposta è si, anche se non sappiamo ancora molto. Siamo però consapevoli che il tocco è la più elementare forma di comunicazione: gioca un ruolo cruciale nella relazione sia nei bambini che tra gli adulti (Farmer and Tsakiris 2013). Ha inoltre una funzione affettiva e simbolica (Kringelbach,2005). Nonostante questo, è indiscutibilmente una modalità sensoriale altamente complessa. La percezione degli stimoli varia da persona a persona, da cultura a cultura, in base alle esperienze di vita e a fattori genetici ed epigenetici (Finnerup et al. 2003).
A livello sistemico il tocco umano attenua la risposta fisiologica allo stress nei bambini e fa diminuire l’espressione del cortisolo (tipico marker legato all’attivazione dell’asse HPA) (Matthews and Janusek 2011).
Inoltre regola i livelli dell’ossitocina, della vasopressina (Morhenn et al. 2012), il tono vagale, diminuisce la percezione dello stress e quella del dolore, migliora l’umore e aumenta la fiducia nelle altre persone, favorendo comportamenti pro-sociali (Nelson and Panksepp 1998).
Anche il massaggio, comunque, ha importanti effetti regolatori dell’asse dello stress. Sono sicuramente interessanti i seguenti due studi che, sicuramente, dovrebbero essere presi come esempio per lo sviluppo della ricerca in campo osteopatico.
Nel primo di questi è stato messo a confronto il massaggio svedese con un tocco leggero. I dati ci dicono che con il massaggio vi è un aumento dei linfociti Treg (fondamentali per la regolazione del sistema immunitario), un aumento dei natural killer (sono cellule immunitarie sensibilissime all’attivazione dell’asse dello stress. Hanno il compito di uccidere i virus e le cellule tumorali che continuamente produciamo), una diminuzione delle citochine del circuito immunitario TH2 (circuito che si iperattiva sotto stress) e, infine, una diminuzione del cortisolo (Rapaport et al. 2012).
Nel secondo studio, invece, con una fRMI si è potuto vedere quali aree cerebrali si attivano durante un massaggio della pianta del piede destro. I dati sono sicuramente interessanti e ci fanno capire l’importanza degli effetti di un tocco: si attivano infatti le cortecce cingolate anteriori e posteriori, l’insula, il talamo. In pratica tutte quelle zone correlate con la sensorialità, la motricità e la coscienza. Non è da sottovalutare il fatto, però, che questi circuiti non si attivano se il massaggio viene eseguito con uno strumento di legno. Ciò mette in risalto la valenza fisiologica del contatto umano (Sliz et al. 2012).
Il massaggio, infine, ha importanti effetti anche nei bambini pre-termine. Si è infatti potuto vedere come la manipolazione dei muscoli delle gambe aumenta l’attività vagale (con l’importantissimo effetto antinfiammatorio), diminuisce la produzione di cortisolo (questo dato ci dice che si abbassa l’asse HPA) e aumenta la produzione di IGF-1 (molecola con importantissime funzioni neurotrofiche) (Field et al. 2011). Il massaggio ha anche importanti effetti sui bambini affetti da autismo o ADHD: migliorano infatti le loro capacità di attenzione, risultano più calmi e dormono meglio (Field 2010).
- Besedovsky H.O. and del Rey A. (2007), Physiology of psychoneuroimmunology: A personal view. In Brain, Behavior, and Immunity 21 (2007) 34-44.
- Bhowmick, S. et al. (2009), The sympathetic nervous system modulates CD4+FoxP3+ regulatory T cells via TGF-β-dependent mechanism. In J Leukocyte Biol, 86, pp. 1275-83.
- Bottaccioli, F. (2005), Psiconeuroendocrinoimmunologia, Red!, Milano.
- Bottaccioli, F. (2008), Il sistema immunitario: la bilancia della vita. Tecniche nuove, Milano.
- Bottaccioli, F. (2014), Epigenetica e Psiconeuroendocrinoimmunologia, Edra, Milano.
- Costanza M et al. (2014), Prolactin: a versatile regulator of inflammation and autoimmune pathology. In Autoimmun Rev. 14(3):223-30.
- Critchley (2005), Neural Mechanisms of Autonomic, Affective, and Cognitive Integration. In J Comp Neurol, 493, 154-66.
- D’Alessandro G. et al. (2016), Sensitization and Interoception as Key Neurological Concepts in Osteopathy and Other Manual Medicines. In Front Neurosci, 100:10.
- De Bellis A. et al. (2005), Prolactin and autoimmunity. In Pituitary, 8(1):25-30.
- Farmer and Tsakiris (2013), Touching hands: A neurocognitive review of intersubjective touch. In Z. Radman (ed.), The Hand, an Organ of the Mind. Cambridge, MA: MIT Press.
- Felten D.L. et al. (1984), Sympathetic innervations of lymph nodes in mice. In Brain Res Bull, 13, pp. 693-9.
- Field (2010), Touch for socioemotional and physical well-being: A review. In Dev Rev, 30, 367-83.
- Field T. et al. (2011), Potential underlying mechanisms for greater weight gain in massaged preterm infants. In Infant Behav Dev.; 34(3):383-9.
- Finnerup et al. (2003), Sensory function in spinal cord injury patients with and without central pain. In Brain, 126(1): 57-70.
- Gallagher S. and Zahavi D. (2008), The Phenomenological Mind, Routledge, New York.
- Hall, J.E. (2011), Guyton and Hall Textbook of Medical Physiology, Saunders, Philadelphia.
- Hart, S. et al. (2001), Anorexia nervosa symptoms are reduced by massage therapy, Eat Disord, 9 (4), pp. 289-99;
- Ingber, D.E. (2003), Tensegrity I. Cell structure and hierarchical systems biology. In J Cell Sci, 116, pp. 1157-73.
- Jacobs C.R. et al. (2013), Introduction to Cell Mechanics and Mechanobiology, Garland Science, New York.
- Kringelbach (2005), The human orbitofrontal cortex: linking reward to hedonic experience. In Nature Reviews Neuroscience, 6(9), 691-702.
- Matthews and Janusek (2011), Epigenetics and psychoneuroimmunology: Mechanisms and models. In Brain Behav Immun., 25(1): 25-39.
- Minasny B. (2009), Understanding the process of fascial unwinding. In Int J Ther Massage Bodywork. 23;2(3):10-7.
- Morhenn V. et al. (2012), Massage increases oxytocin and reduces adrenocorticotropin hormone in humans. In Altern Ther Health Med.;18(6):11-8.
- Nelson E.E. and Panksepp J. (1998), Brain substrates of infant-mother attachment: contributions of opioids, oxytocin, and norepinephrine. In Neurosci Biobehav Rev. 22(3):437-52.
- Paulus, M.P. and Stein, M.B. (2010), Interoception in anxiety and depression. Brain Struct Funct, 214 (5-6), 451-63.
- Rapaport M.H. et al. (2012), A Preliminary Study of the Effects of Repeated Massage on Hypothalamic-Pituitary-Adrenal and Immune Function in Healthy Individuals: A Study of Mechanisms of Action and Dosage. In J Altern Complement Med, 18 (8), 789-97.
- Reilly G.C. et al. (2003), Fluid flow induced PGE2 release by bone cells is reduced by glycocalyx degradation whereas calcium signals are not. In Biorheology 40, 591-603.
- Ruffini, N. et al. (2015), Variations of high frequency parameter of heart rate variability following osteopathic manipulative treatment in healthy subjects compared to control group and sham therapy: randomized controlled trial. In Front Neurosci, 9: 272.
- Schleip, R. (2003), Fascial plasticity – a new neurobiological explanation: Part 1. In J Bodyw Mov Ther, 7 (1), pp. 11-9.
- Schleip, R. et al. (2006), Fascia Is Able to Contract in a Smooth Muscle-like Manner and Thereby Influence Musculoskeletal Mechanics. In Leipsch, D. (ed.), 5th World Congress of Biomechanics, Medimond, Munich.
- Schleip, R. and Jager H. (2012), Fascia is alive: How cells modulate the tonicity and architecture of fascial tissue. In Fascia: the Tensional Network of the Human Body, Elsevier, Edinburgh, pp. 157-64.
- Serino and Haggard (2010), Touch and the body. In Neurosci Biobehav Rev, 34, pp. 224-36.
- Sliz, D. et al. (2012), Neural correlates of a single-session massage treatment. In Brain Imaging Behav, 6, 77-87.
- Squire R.F. et al. (2013), Prefrontal contributions to visual selective attention. In Annu Rev Neurosci. 8;36:451-66.
- Stecco, L. (2012), Manipolazione fasciale: per le disfunzioni interne, Piccin, Padova.
- Stecco, L. & Stecco, A. (2010), Manipolazione fasciale: parte teorica, Piccin, Padova.
- Tadeo, I. et al. (2014), Biotensegrity of the extracellular matrix: physiology, dynamic mechanical balance, and implications in oncology and mechanotherapy. In Front Oncol, 4: 39.
- Tracey K.J. (2007), Physiology and immunology of the cholinergic antiinflammatory pathway. In J Clin Invest, 117, pp. 289-96.

