Petros C.Benias, Rebecca G.Wells, Bridget Sackey-Aboagye et al. Scientific Reports 8, Article number:4947(2018)
Scarica l’articolo in formato pdf
Lo spazio interstiziale rappresenta la fonte primaria di linfa ed è un rilevante compartimento di fluidi nel corpo. La comprensione dell’anatomia e della composizione di tale spazio intercellulare è in costante sviluppo, mentre poco si sa sulla presenza, localizzazione e struttura di spazi intra ed extra tissutali più ampi.
Ciò è particolarmente rilevante in riferimento al “third spacing”,
ovvero l’accumulo di fluido interstiziale, il flusso e il volume totale di
questo fluido, argomenti ancora oggi poco studiati.
La tecnica di microscopia in vivo offre la possibilità di identificare
negli esseri umani nuove strutture anatomiche, rilevanti dal punto di
vista funzionale. Recentemente, grazie alla microscopia intravitale
multifotone e l’adeguata preparazione del cranio (thinned skull
preparation), è stato possibile identificare per la prima volta i vasi
linfatici del cervello.
L’endomicroscopia confocale laser a sonda (Probe-based Confocal
Laser Endomicroscopy, pCLE) è una tecnica per immagini in vivo che
fornisce, in tempo reale, valutazioni istologiche delle strutture
tissutali durante l’endoscopia, di solito in seguito a un’iniezione
endovenosa di fluoresceina. Nel presente studio e anche in altri è
stato osservato che nei dotti biliari extraepatici e in quelli pancreatici
la pCLE a una lunghezza focale fissa di 60-70 μm mostra uno
“schema reticolare” sottomucoso che consiste in 20 μm di fasci
larghi e ramificati che circondano degli ampi spazi poligonali ripieni
di fluoresceina. Tali risultati non presentano evidenti correlazioni con
strutture già conosciute. Sebbene gli endoscopisti abbiano suggerito
che questa rete possa rappresentare capillari o vasi linfatici
(lymphangioles), nessuna struttura è in grado di spiegare lo schema
reticolare di fasci scuri e luminosi ripieni di fluido.
Abbiamo avanzato l’ipotesi che questo schema rifletta un’estensione dello spazio interstiziale intercellulare. Abbiamo realizzato uno studio approfondito utilizzando la pCLE ed esami istologici del dotto biliare extraepatico umano per identificare le relazioni microanatomiche dello schema reticolare.
Nella presente ricerca riferiamo l’esistenza di un nuovo spazio interstiziale (ovvero pre-linfatico) definito da un complesso reticolo di fasci di collagene denso. È stato possibile osservare strutture simili quando abbiamo esteso la nostra analisi includendovi il derma, lo stroma periarteriale, la sottomucosa viscerale (tratto gastrointestinale, vescica), gli alberi bronchiali dei polmoni e i piani fasciali del sistema muscoloscheletrico e del tessuto adiposo. Proponiamo quindi una revisione su larga scala della macro e micro anatomia dell’interstizio umano.
Risultati
I campioni sono stati ottenuti da porzioni di dotti biliari recise
durante dodici interventi chirurgici pancreatico-biliari. Alcuni minuti
prima della legatura vascolare e della resezione del campione
chirurgico ai pazienti è stata iniettata la fluoresceina visualizzazando
direttamente in situ, tramite pCLE, lo schema reticolare.
Il campione è stato quindi reciso e subito dopo nuovamente
scannerizzato con la pCLE ex vivo, per confermare che il reticolo e la
fluoresceina fossero ancora intatti dopo la resezione.
Successivamente i campioni sono stati inclusi su appositi vetrini, rapidamente congelati mediante uno spray congelante e nuovamente scannerizzati. Alcune sezioni congelate sono state tagliate perpendicolarmente con sezioni ogni 5 μm fino a raggiungere la profondità di 60-70 μm.
Inoltre abbiamo realizzato sezioni tissutali seriali sul piano trasversale. Tali sezioni sono state visualizzate attraverso la microscopia a fluorescenza standard, rilevando una correlazione tra lo schema reticolare e i fasci densi colorati con la fluoresceina (visibili sulla pCLE come fasci neri).
L’assenza di fluorescenza tra questi fasci nelle ultime immagini è dovuta al processo di congelamento delle sezioni (essicazione, fissazione e lavaggio) che ha causato il drenaggio dei fluidi.
Altre sezioni congelate sono state tinte con la colorazione tricromica di Masson, ciò ha confermato la presenza di fasci di collagene che separano spazi aperti ripieni di fluidi. Tali strutture erano localizzate in corrispondenza della sottomucosa biliare compatta normalmente visibile durante la biopsia o la resezione dei campioni.
Ciò significa che la struttura densa della sottomucosa, descritta in precedenza, rappresenta un artefatto poiché la perdita di fluidi durante il taglio e il fissaggio dei tessuti determina il collasso e l’aderenza dei fasci di collagene che normalmente risulterebbero separati.
Abbiamo rilevato che lo schema reticolare compare entro 30 secondi dall’iniezione endovenosa di fluoresceina, quasi contemporaneamente alla visualizzazione dei linfonodi, ma più tardi rispetto alla visualizzazione delle strutture vascolari. Questo ci indica che il reticolo rappresenta una forma di spazio interstiziale in cui il fluido interstiziale o “pre-linfa” si accumula o si forma.
L’immunocolorazione della sottomucosa del dotto biliare congelata e fissata ha mostrato una colorazione positiva ai marcatori CD34 e D2- 40 su un lato di ogni fascio di collagene. L’immunocolorazione è risultata negativa per altri marcatori endoteliali linfovascolari (CD31, ERG, LYVE-1), ma positiva in modo uniforme per il marcatore mesenchimale vimentina. Le colorazioni per il marcatore mioepiteliale actina del muscolo liscio, per il marcatore delle cellule staminali CD117 e per la beta-catenina nucleare sono risultate negative.
Studi ultrastrutturali dimostrano che i fasci di collagene sono rivestiti in modo asimmetrico su un lato da cellule sottili e piatte (di forma affusolata nella sezione trasversale) che hanno un citoplasma scarso e un nucleo oblungo. Queste cellule sono simili ai fibroblasti e non possiedono strutture cellulari specifiche.
In particolare sono sprovviste di caratteristiche ultrastrutturali indicative della differenziazzione endoteliale, incluse le vesciche pinocitotiche e i corpi di Weibel-Palade. Inoltre la microscopia elettronica dimostra che queste cellule non possiedono una membrana basale aderendo quindi direttamente ai sottostanti fasci di collagene. I fasci rivestiti da un solo lato dalle cellule solitamente non presentano alcun rivestimento sul lato opposto e sono, quindi, direttamente esposti ai fluidi presenti nello spazio.
È stato possibile osservare anche delle fibre elastiche autofluorescenti come già riportato per la lamina elastica delle arterie negli stessi tessuti e dalla colorazione elastica Van Gieson. I tratti istologici caratteristici di questa conformazione della sottomucosa del dotto biliare (spazi ripieni di fluido e con fasci di collagene rivestiti asimmetricamente da cellule piatte) sono facilmente visualizzati in altri tessuti.
La struttura è stata osservata sistematicamente nel derma, in campioni clinicamente sezionati di pelle (Fig 3A), e la pCLE applicata ad aree sottili della pelle in vivo dopo iniezioni di fluoresceina ha rilevato lo stesso reticolo presente nel dotto biliare. Gli spazi ricolmi di fluido e i fasci di collagene, segnati dalla colorazione delle cellule per il marcatore CD34, sono visibili nell’analisi istologica di numerosi organi e tessuti, inclusa la sottomucosa di tutto il tratto digerente, la vescica, il tessuto peribronchiale, la fascia e lo stroma di arterie e vene di tutte le dimensioni (Fig. 3B)
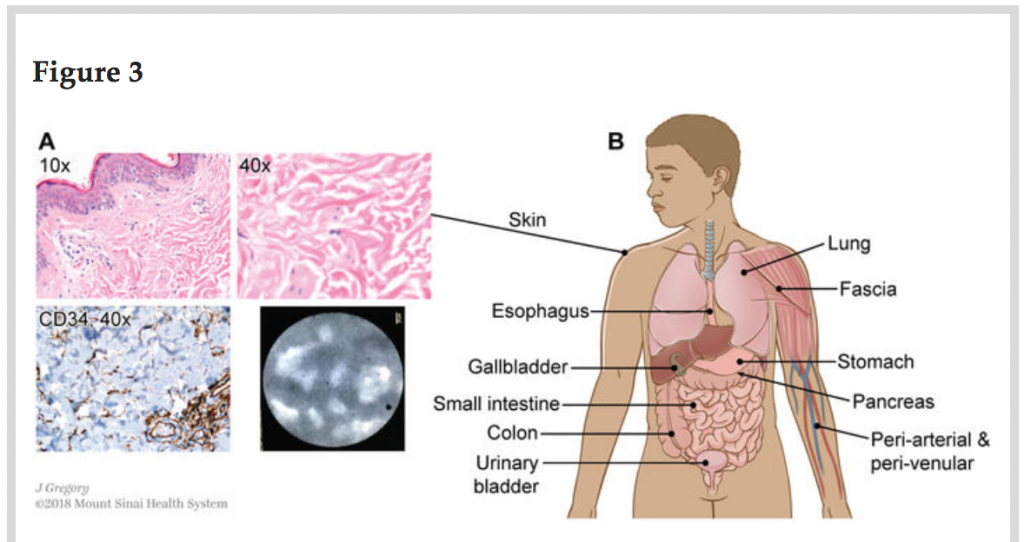
Illustrazione di Jill Gregory. Stampato con il permesso del Mount Sinai Health System
Lo spazio interstiziale si trova nel derma, nella sottomucosa e in altri tessuti fibroconnettivali del corpo. (A) La pelle colorata con H&E (in alto a sinistra 10x, in alto a destra 40x) mostra le stesse strutture identificate nel dotto biliare extraepatico.
L’immunocolorazione per il CD34 (in basso a sinistra, DAB marrone, colorazione con ematossilina in azzurro, 40x) evidenzia che le cellule di rivestimento sono intermittenti e spesso presenti solo su un lato dei fasci di collagene. Seguendo questa osservazione istologica possiamo affermare che la pCLE in vivo eseguita sul derma ha confermato la capacità della conformazione istologica di preannunciare lo schema reticolare rilevato con la pCLE. (B) Illustrazione schematica della localizzazione di strutture istologiche identiche nel tessuto fibroconnettivale del corpo.
Tali strutture sembrano essere spazi pre-linfatici, come suggerito dagli esami eseguiti su campioni di tumore colorettale dotati di tatuaggio della sottomucosa. I pigmenti neri sono presenti nei macrofagi all’interno dello spazio interstiziale ma anche nei macrofagi dei linfonodi mesenterici associati.
Questi macrofagi non sono osservabili negli spazi interstiziali durante l’esame di tessuti normali e si ipotizza che essi migrino nell’interstizio in risposta alla presenza di materiale estraneo.
Inoltre, l’analisi di piccoli campioni di ernie incarcerate con ostruzione dell’intestino prossimale mostra una sottomucosa con diffuso allargamento dei fasci di collagene a causa di un fluido (rosa) proteico istologicamente simile alla linfa.
La natura pre-linfatica di questo spazio è enfatizzata dallo studio di tumori invasivi allo stomaco e alla pelle di stadio T2. Tale stadio è definito come il coinvolgimento della sottomucosa, ma non oltre. L’invasione di stadio T2 della pelle indica l’interessamento diretto del derma, ma non oltre. L’invasione da parte di un carcinoma gastrico invasivo scarsamente differenziato indica una diffusione attraverso lo spazio interstiziale che circonda i fasci di collagene ancora intatti. Sebbene nel caso di questo campione non sia presente un’invasione linfovascolare dimostrabile è stata individuata una metastasi fino al linfonodo mesenterico drenante. In un melanoma maligno che si diffonde alla parte superiore del braccio e interessa direttamente il derma è rilevabile una diffusione simile attraverso lo spazio interstiziale con isolamento dei fasci di collagene.
Di nuovo, malgrado l’assenza di invasione linfovascolare dimostrabile è presente una metastasi di un linfonodo drenante dell’ascella. In entrambi i casi non sono state identificate altre lesioni o vie di diffusione, nemmeno in seguito alla valutazione clinica e istologica completa del paziente.
Discussione
Nel presente studio proponiamo una revisione dei concetti anatomici di sottomucosa, derma, fascia e avventizia vascolare, e avanziamo l’idea che essi siano degli spazi interstiziali ripieni di fluido e non delle pareti di collagene simili a barriere densamente raggruppate. La presenza di fluido ha implicazioni significative per il tessuto sia da un punto di vista funzionale che patologico. I nostri dati, che confrontano campioni tissutali rapidamente prelevati mediante biopsia, congelati e fissati in maniera standard, suggeriscono che gli spazi qui descritti, sostenuti e organizzati da un reticolo di collagene possono essere compressi e distesi e possono, quindi, fungere da ammortizzatori.
Tutti gli organi in cui abbiamo individuato questa struttura sono soggetti a cicli di compressione e distensione, sia di tipo costante (polmoni, aorta) che intermittente (tratto digerente dopo un pasto, la vescica durante la minzione, la pelle sotto compressione meccanica, i piani fasciali durante l’azione dell’apparato muscoloscheletrico). L’interstizio del derma e quello fasciale potrebbero risultare importanti da un punto di vista meccanico per spiegare l’edema.
Il concetto di “third spacing” nel linfedema postchirurgico (come nella recisione di nodi drenanti) e l’anasarca causata dall’insufficienza epatica, renale o cardiaca potrebbero riflettere la distensione e la stasi del fluido nello spazio interstiziale.
Ulteriori prove a supporto della relazione tra le caratteristiche istologiche che osserviamo e le strutture in vivo arrivano dall’ecografia dei tessuti. L’ecografia endoscopica del dotto billiare mostra la sua struttura a tre strati: il medio, che rappresenta il 90% dello spessore della parete, è pieno di fluido e corrisponde all’interstizio sottomucoso. Gli spazi sottomucosi di altri visceri, del derma e della fascia appaiono eterogenei all’esame ecografico, caratteristica tipica del tessuto fluido o adiposo, mentre il vero stroma collagenizzato, come nei tendini o nei legamenti, appare di colore scuro all’ecografia.
Altri dati a supporto delle nostre osservazioni si riscontrano negli studi ultrastrutturali sulla pelle, sull’appendice vermiforme e sull’avventizia periaortica che sembrano mostrare le stesse strutture, sebbene poco definite. L’area identificata come spazio di Mall nella regione portale del fegato potrebbe rappresentare questo interstizio. In effetti i disegni originali di Mall, risultato degli studi a iniezione, sembrano illustrare le stesse strutture identificate nella presente ricerca.
La natura delle cellule di rivestimento è poco chiara. Mentre le
cellule del dotto biliare extraepatico si sono colorate sia per il CD34
che per il D2-40, la colorazione per il D2-40 era assente in tutti gli
altri tessuti esaminati. Anche le cellule endoteliali vascolari co-
esprimono il CD34 e la vimentina, ma la mancanza di caratteristiche
endoteliali all’esame di microscopia elettronica esclude questa
classificazione per le cellule che rivestono l’interstizio, indicandole
invece come una nuova forma di fibroblasto o di cellula staminale
mesenchimale positiva al CD34.
Se queste siano o meno le cellule che formano i fasci di collagene è
ancora incerto, se così fosse sarebbero importanti nella formazione
delle cicatrici durante la guarigione delle ferite. Da notare che le
cicatrici cheloidee mostrano fasci di collagene e ampi spazi che
sembrano un’ingrandimento delle strutture presenti nel derma
sottostante. Dati recenti, che dimostrano la comparsa di
cicatrici cheloidee in regioni della pelle sottoposte a grande
pressione, sollevano questioni sull’impatto delle forze
meccaniche e del flusso dei fluidi sulle strutture e le cellule di
questo spazio.
È probabile che l’interstizio sottomucoso qui descritto corrisponda agli spazi interstiziali descritti negli studi sui cluster cellulari che hanno metastatizzato. La presenza di una rete di canali interstiziali nel tratto digerente e in quello urinario potrebbe spiegare l’aumento delle probabilità di metastasi nel caso di tumori invasivi una volta raggiunta la sottomucosa. Come illustrato dai casi di melanoma invasivo e di tumore gastrico presi in esame, la presenza di canali ripieni di fluido nella sottomucosa o nel derma spiegherebbe il motivo per cui le lesioni T2 comportano un rischio significativamente maggiore a sviluppare metastasi rispetto alle lesioni T1. Poiché la sottomucosa viscerale e il derma sono spazi aperti ripieni di fluido, invece di pareti di tessuto connettivo denso, esse risultano facilmente attraversabili dalle cellule dei tumori invasivi. Inoltre la pressione meccanica che grava su tali spazi (peristalsi nel tratto digerente, compressioni e/o movimento pressorio associato alla pelle) potrebbe promuovere un’ulteriore diffusione attraverso questi spazi.
Se le cellule del rivestimento interstiziale rappresentano le precorritrici dei miofibroblasti fibrogenici, potrebbero fungere anche da “primo soccorso” nella sclerosi peritumorale dell’albero pancreatico-biliare, del tratto digerente, dell’albero bronchiale, della vescica e della pelle. Precisamente è stata riferita una popolazione unica di fibroblasti peritumorali che co-esprimono il CD34 e la vimentina. Tali cellule potrebbero avere un ruolo importante in patologie sclerotiche non maligne come l’atresia biliare, la colangite sclerosante primitiva dell’albero biliare, la sclerodermia del derma e dell’esofago e le malattie infiammatorie intestinali del tratto digerente. Studi in corso si stanno focalizzando sulla caratterizzazione di queste cellule e sulle loro funzioni.
È probabile che il flusso del fluido interstiziale attraverso lo spazio sottomucoso del tratto gastrointestinale luminale sia guidato dalla peristalsi in parallelo con il contenuto luminale.
La presenza di comunicazione tra il lume dell’intestino e lo spazio sottomucoso aumenta le probabilità che la segnalazione cellulare (inclusi i segnali ormonali e immunologici) possa essere condotta dalla posizione prossimale a quella distale e determinata dalla velocità della peristalsi.
I fasci di collagene nello spazio interstiziale sono rivestiti da un solo
lato da cellule, ciò implica che la matrice di collagene sul lato
opposto sia a diretto contatto con il fluido interstiziale.
Nel corpo umano esistono pochi altri esempi, oltre allo spazio
interstiziale intercellulare, in cui il fluido è a diretto contatto con le
proteine della matrice senza l’intervento di una barriera cellulare e
sono il glomerulo renale e lo spazio di Disse.
Le fibre di collagene, che sono molecole caricate, potrebbero
formare un’importante superficie fisicamente attiva.
Se le cellule del sistema immunitario o altre cellule che
attraversano tale spazio interagiscano o meno con i fasci di
collagene è una questione fisiologicamente rilevante e
necessita di ulteriori ricerche.
Riassumendo, mentre la comune descrizione dell’interstizio suggerisce la presenza di spazio tra le cellule, nel presente studio descriviamo degli spazi intratissutali visibili a livello macroscopico; seni che possono essere compressi e distesi dinamicamente e attraverso cui il fluido interstiziale scorre nel corpo.
I nostri dati rendono necessario riconsiderare molte attività funzionali normali degli organi ma anche la dinamica disfunzionale dei fluidi in contesto patologico, inclusi i casi di fibrosi e mestastasi.
Una sottomucosa soggetta a un flusso direzionale e peristaltico non è la parete di tessuto connettivo immaginata in precedenza, ma un potenziale condotto per il passaggio di agenti nocivi, di molecole pro-fibrogeniche di segnalazione e di cellule tumorali. Ciò aumenta le possibilità che il campionamento diretto del fluido interstiziale possa diventare uno strumento diagnostico.
Infine il presente studio dimostra la capacità della microscopia in vivo di generare nuove conoscenze dell’anatomia e della fisiologia dei tessuti normali e di quelli malati.