Lo scambio di segnali tra i sistemi immunitario, endocrino e nervoso
per l’immunoregolazione e le funzioni cerebrali
Hugo O. Besedovsky, Adriana del Rey
Questo articolo offre una visione personale su come il concetto dell’esistenza di una rete di interazioni immuno-neuro-endocrine si è evoluto negli ultimi 30 anni. L’argomento principale esaminato è l’importanza dello scambio di segnali tra i sistemi immunitario, endocrino e nervoso per l’immunoregolazione e le funzioni cerebrali. Particolare enfasi è stata data ai circuiti che interessano i prodotti della cellula immunitaria, l’asse ipotalamo- ipofisi-surrene ed il sistema nervoso simpatico. L’attività di questi circuiti può interessare le funzioni immunitarie e il decorso delle malattie infiammatorie, autoimmuni e infettive. E’ discussa anche l’evidenza sempre più notevole del fatto che le citochine di origine cerebrale giocano un ruolo importante nella fisiologia del cervello e nell’integrazione della rete immuno-neuro-endocrina.
Scarica la sintesi in italiano in formato PDF (236 Kb)
L’articolo originale (Brain, Behavior, and Immunity 2007; 21: 34–44)
1. INTRODUZIONE: ASPETTI GENERALI E DEFINIZIONI
Non molto tempo fa (almeno per quanto riguarda la misura del tempo nella scienza), quando si intendeva introdurre un articolo sulle interazioni tra i sistemi immunitario, endocrino e nervoso, ci si riferiva ad un campo “emergente”. Questo tipo di introduzione non è più giustificabile, dato che quest’area di ricerca è ora decisamente consolidata. La comparsa di “Brain, Behavior and Immunity” 20 anni fa, è stata un pilastro importante
per il suo consolidamento. Prima era difficile convincere recensori delle riviste focalizzate su una specifica specializzazione che i confini tra le discipline sono relativi e talvolta auto- imposti. Gli autori sostengono che la serie speciale di BBI (Brain,Behavior and Immunity) sia importante perché fornisce una prospettiva storica che potrebbe servire a influenzare correnti di pensiero e sviluppi futuri. In relazione a ciò, i ricercatori intendono chiarire che, secondo la loro visione, hanno trattato l’aspetto probabilmente più ampio di questo campo; così, il contributo è ben lontano dall’essere un tentativo di riesaminare i progressi nella “Fisiologia della Psico-neuroimmunologia”. Sono enfatizzati alcuni aspetti dell’Immunofisiologia, come per esempio le interazioni attive tra il sistema immunitario (IS) e l’asse ipotalamo-ipofisi-surrene (HPA) o il sistema nervoso simpatico (SNS), e il ruolo delle citochine di origine periferica e centrale come mediatrici di queste interazioni. Le interazioni con altri sistemi endocrini e autonomi non sono menzionate, o lo sono solo marginalmente. Aspetti come stress, sonno e comportamento vengono considerati in altri articoli di questa serie.
Parte di questo articolo è stata scritta come una specie di “autobiografia scientifica” dato che, appartenendo alla “vecchia” generazione, è stato ritenuto dagli autori che condividere l’esperienza maturatapotrebbe essere interessante per le nuove generazioni che sicuramente saranno autrici delle svolte che questo campo necessita. A causa dello spazio limitato, il lavoro di molti colleghi non è stato citato e neanche accennato. Con qualche eccezione, le citazioni a partire da prima del 1987 e il 1996 sono state omesse. Queste citazioni si possono trovare in riviste meno recenti (Besedovsky and del Rey,1996; Besedovsky and Sorkin, 1997).
Inoltre, i ricercatori vogliono chiarire un aspetto che costituisce l’”essenza” della Fisiologia. Non c’è dubbio che il sistema immunitario è un sistema fisiologico omeostatico che, entro certi limiti, contribuisce alla stabilità e all’integrità dell’organismo (auto-conservazione e neutralizzazione dei pericoli). Comunque, causa di confusione potrebbe essere il fatto che, mentre le risposte immunitarie sono risposte fisiologiche che ci si aspetta efficienti al massimo durante le malattie infettivo–infiammatorie, esse talvolta contribuiscono ad innescare patologie. Così, sebbene il controllo e la regolazione dei diversi sistemi di un organismo sia al centro della Fisiologia, l’unica condizione, nel caso dell’immunoregolazione, è che tale processo fisiologico operi simultaneamente e collegato strettamente con gli eventi patologici. Un altro punto da notare è che la “Fisiologia” (come indica la sua etimologia derivante dal greco Physis = Natura) è una disciplina che tratta i processi naturali. Così, per esempio, ogni scoperta sull’effetto di un ormone su un dato parametro immunologico, seguendo un approccio farmacologico, dovrebbe essere seguita da studi che stabiliscano se tale effetto venga anche osservato sotto condizioni naturali, fisiologiche o patofisiologiche.
2. PRIMA DEL 1987: LA “VECCHIA” GENERAZIONE
Molti epidemiologi concordano sul fatto che l’acquisizione della conoscenza scientifica sia preceduta e suffragata da considerazioni deduttivo-intuitive. Il lavoro sulle interazioni immuno-neuro-endocrine 35 anni fa era in gran parte basato sull’intuizione poiché era fondato sulla convinzione che il sistema immunitario, come altri sistemi fisiologici, dovesse anche essere soggetto al controllo integrativo dei meccanismi neuro-endocrini. Infatti, i dati disponibili erano relativamente scarsi e basati, per esempio, sull’effetto della manipolazione di certe aree cerebrali e di meccanismi endocrini in alcuni processi immunitari che, in molti casi, non sono adattabili, come per esempio, nell’ipersensibilità acuta.
Recettori per solo pochi ormoni, come l’insulina, o neurotrasmettitori, come gli agenti adrenergici, sono stati identificati, o ipotizzati, sulle cellule immunitarie. C’è stato anche qualche studio che dimostrava delle interazioni tra i meccanismi neuro-endocrini e immunitari durante l’ontogenesi, come è il caso dell’effetto del timo sulla maturazione delle funzioni sessuali. Tuttavia, le informazioni disponibili sono state appena sufficienti per la formulazione iniziale dell’ipotesi che le risposte immunitarie sono soggette ad un livello di regolazione neuro-endocrina. Come succede con altre regolazioni fisiologiche, i meccanismi immunoregolatori neuro-endocrini devono essere basati sull’attività di scambi d’informazioni tra le cellule immunitarie e i sistemi nervoso ed endocrino. Poiché le risposte immunitarie, sia innate che acquisite, coinvolgono cellule e mediatori diversi a differenti stadi, la loro estrinseca regolazione dovrebbe essere basata su modificazioni neurali ed endocrine ben sincronizzate. Tali modificazioni, a loro volta, dovrebbero essere in grado di modulare l’attività delle cellule immunitarie su stadi definiti della risposta immunitaria.
Per verificare sperimentalmente l’ipotesi già menzionata, è stato necessario dimostrare che:
- le modificazioni neuro-endocrine che si verificano durante la risposta immunitaria non sono conseguenza della malattia o dello stress provocato dall’essere ammalato;
- le risposte neuro-endocrine immunologicamente indotte possono influenzare il funzionamento del sistema immunitario.
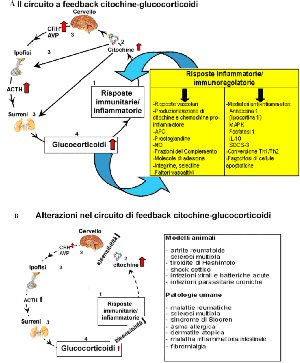
Seguendo questi criteri, è stato possibile dimostrare che i livelli di glucocorticoidi nel sangue sono aumentati in un modo soglia-dipendente durante il corso di specifiche risposte immunitarie ad antigeni innocui. E’ stato altresì dimostrato che l’aumento dei livelli di corticosterone durante la risposta ad un antigene può interferire con la risposta ad un secondo antigene non in relazione con il primo. Questa scoperta, che ha fornito una spiegazione al fenomeno della competizione tra antigeni, ha indicato che la modificazione endocrina osservata è stata rilevante per l’immunoregolazione. Sorprendentemente, mentre gli autori cercavano di indurre una competizione antigenica in vitro, hanno anche osservato che basse dosi di glucocorticoidi potevano aumentare il numero di cellule producenti specifici anticorpi.
La domanda che ci si è posto è stata: come possono scambiarsi informazioni due distinti sistemi del corpo, quello immunitario e quello endocrino? Per rispondere a questa domanda, sono state stimolate le cellule immunitarie con mitogeni o antigeni in vitro ed è stato scoperto che sovranatanti privi di cellule ottenuti da queste colture contenevano fattori capaci di stimolare l’asse ipotalamo-ipofisi-surrene (Besedovsky et al., 1981), un effetto che veniva mediato dall’ipofisi. Questa sostanza è stata chiamata “fattore che incrementa il glucocorticoide” (GIF). Fortunatamente, non ci si è sforzato eccessivamente di purificare questo fattore, perché, come si dirà dopo, varie citochine condividono la capacità di stimolare l’asse ipotalamo-ipofisi-surrene. Questa scoperta ha portato ad ipotizzare l’attività di un circuito immunoregolatore dell’asse immunitario ipotalamo-ipofisi-surrene.
Quasi nello stesso momento in cui tali studi furono pubblicati, Smith e colleghi riportarono che i glucocorticoidi interferiscono con la produzione del fattore di crescita della cellula T (come allora era chiamato IL-2) e degli altri prodotti immunitari. Venne anche dimostrato che i cambiamenti nei livelli endogeni di glucocorticoidi possono inibire la produzione di immunoglobulina. Inoltre, si scoprì che le rimanenti cellule immunitarie sono più sensibili agli effetti inibitori dei glucocorticoidi delle cellule attivate. Su queste basi, è stato ipotizzato che il circuito dell’asse immunitario ipotalamo-ipofisi-surrene può avere la funzione di prevenire l’eccessiva espansione di cellule a bassa affinità verso l’antigene e di quelle cellule reclutate sotto l’influenza policlonale delle linfochine. In questo modo, la specificità della risposta immunitaria potrebbe essere preservata e perfino migliorata. E’ intuibile che questo circuito, impedendo un’eccessiva espansione indistinta di cellule linfatiche e accessorie, gioca un suo ruolo nel prevenire malattie autoimmuni e linfoproliferative. Esempi sperimentali e clinici dimostranti l’importanza del circuito immunitario basato sull’asse ipotalamo-ipofisi-surrene saranno citati più avanti in quest’articolo.
Quando sono stati studiati i meccanismi con cui la noradrenalina induce l’apoptosi delle cellule linfatiche, è stato scoperto che questo processo è indipendente da un Fas funzionale. Così, sono stati usati topi lpr/lpr, che sono privi dell’espressione del Fas funzionale (CD95) e sono, quindi, mancanti di un meccanismo critico per il mantenimento della tolleranza periferica, per indagare se i nervi noradrenergici possano influenzare l’espressione della malattia autoimmune linfoproliferativa che sviluppano spontaneamente.
Nella milza dei topi lpr/lpr, nei primi istanti dell’ontogenesi, la concentrazione di noradrenalina è significativamente aumentata, ma l’innervazione splenica del simpatico gradualmente diminuisce col progredire della malattia. Inoltre, i livelli sanguigni di IgM e la concentrazione splenica di noradrenalina sono inversamente correlati quando la malattia si manifesta in modo conclamato.
La simpatectomia nei neonati di topo, che anticipa sperimentalmente la perdita della denervazione che avviene spontaneamente nell’età adulta, dà luogo a una significativamente aumentata concentrazione di IgM e IgG2a nel sangue, accelera l’esordio di linfoadenopatie e accorcia notevolmente il tempo di sopravvivenza dei topi lpr/lpr. Questi dati dimostrano che, oltre alle imperfezioni nella via metabolica Fas, un’innervazione del sistema simpatico dei topi lpr/lpr contribuisce anche alla patogenesi della malattia autoimmune, e supporta fortemente l’ipotesi che il sistema nervoso simpatico possa modulare l’espressione delle malattie linfoproliferative (del Rey et l., 2002; del Rey e al., 2006).
Una valutazione generale delle opinioni odierne sull’immunoregolazione svolta dal simpatico può essere riassunta come segue. Le prove disponibili dimostrano che quasi tutti i meccanismi coinvolti in una risposta immunitaria possono essere influenzati dai neurotrasmettitori noradrenergici (vedi Elenkov et al., 2000; Sanders, 2006). Senza dubbio, la noradrenalina può inibire o stimolare una risposta immunitaria a seconda della dose di agonista somministrata e del tipo di recettore adrenergico stimolato. L‘effetto della noradrenalina dipende anche dal tipo di stimolo che innesca la risposta immunitaria, dal sottogruppo di cellule coinvolte, e, con maggior importanza, dalla fase della risposta durante la quale le cellule linfatiche e/o accessorie sono esposte ai neurotrasmettitori.
Tra i processi direttamente o indirettamente influenzati dai neurotrasmettitori del sistema simpatico ci sono la presentazione degli antigeni e l’espressione delle molecole co-stimolatorie e di adesione, l’attivazione delle cellule linfatiche, la produzione di citochine, l’espansione e il blocco clonale, la produzione di immunoglobuline, e la generazione di cellule citotossiche. Il fatto che la stimolazione simultanea dei recettori adrenergici e del recettore della cellula T influenzi vie comuni di segnalamento intra-cellulare potrebbe spiegare perché gli agonisti adrenergici possano influenzare una così grande quantità di meccanismi coinvolti in una risposta immunitaria.
L’interesse nella comprensione dell’importanza dell’altro ramo del sistema nervoso autonomo, il sistema para-simpatico, è aumentato negli ultimi anni. Esistono dei segnali che indicano che le fibre efferenti del nervo vago esercitano un ruolo protettivo nello shock endo-tossico. La prova è basata sul fatto che la vagotomia cervicale bilaterale aggrava l’abbassamento della pressione del sangue causata a una dose letale di LPS e sul fatto che la stimolazione delle fibre efferenti vagali modulano questo effetto. La conclusione che il nervo vago protegge l’ospite dallo shock endo-tossico è stata anche ricavata dal fatto che l’aumento di citochine, come il TNFAlfa, avviene negli animali vagotomizzati, mentre la stimolazione delle fibre efferenti del vago inverte quest’effetto.
Inoltre, usando un modello di infiammazione mediato dalla carragenina, si è dimostrato che l’attivazione dei recettori della nicotina, sia attraverso la stimolazione del nervo vago che attraverso gli agonisti colinergici, inibisce significativamente il rilascio di citochine pro-infiammatorie e blocca la migrazione dei leucociti. Esperimenti in vitro, in cui vennero usati macrofagi umani, hanno confermato che l’acetilcolina e gli antagonisti colinergici inibiscono il rilascio di TNF, IL-1 e IL-18 in risposta all’endo-tossina e che quest’effetto viene esercitato a livelli post-trascrizionali. Gli studi farmacologici indicano chiaramente che la stimolazione dei recettori colinergici della nicotina possono essere coinvolti nel controllo delle risposte infiammatorie esagerate (vedi Tracey, 2002). Questi studi, e quelli precedenti, costituiscono un aspetto importante della ricerca sulle interazioni immuno-neuro-endocrine che più probabilmente dimostra la rilevanza del sistema nervoso para-simpatico per l’immunoregolazione anche in condizioni meno estreme dello shock endo-tossico.
L’importanza del rilascio del neuro-peptide durante i processi infiammatori autoimmuni è diventata più evidente e quest’argomento è stato esaminato da varie riviste. Alcuni neuro-peptidi, in particolare SP, sono chiaramente pro-infiammatori, mentre altri, come VIP e PACAP, sono anti-infiammatori. Questi effetti sono stati riscontrati in modelli diversi di patologie, come lo shock settico, l’artrite reumatoide e la sclerosi multipla (Delgado et al., 2004; Jessop, 2002). Bisogna ancora chiarire fino a che punto la stimolazione dell’asse ipotalamo-ipofisi-surrene che risulta dalla somministrazione di questi neuro-peptidi contribuisca a tali effetti (Nussdorfer and Malendowicz, 1998).
Esistono oggi prove considerevoli che le citochine originate nel cervello possono influenzare i meccanismi del sistema nervoso centrale. Si è dimostrato che le citochine sono “fattori del sonno” e che influenzano sia i movimenti oculari non-rapidi che la fase di sonno REM. Livelli cerebrali di IL-1 e TNF concorrono alla propensione al sonno; per esempio, il loro livello aumenta dopo la privazione del sonno. Inoltre, la neutralizzazione immunitaria di IL-1 o il blocco del suo recettore nel cervello influenza il sonno a onde lente (Obal and Krueger 2003), indicando che IL-1 e TNF endogeni sono parte di una complessa cascata biochimica che regola il sonno. E’ stato anche dimostrato che l‘espressione di IL-1 può essere indotta nel cervello in stato di stress (vedi Besedovsky and del Rey, 1996) e che alcuni dei sintomi di “sickness behavior” sono integrati dalle citochine prodotte nel cervello. Per “sickness behavior” si intende un insieme coordinato di cambiamenti soggettivi, comportamentali e psicologici che si sviluppano negli individui malati nel corso di infezioni acute. Questi cambiamenti sono causati dagli effetti di IL-1 e di altre citochine pro-infiammatorie su bersagli cellulari del cervello. Senza dubbio, l’interferenza con gli effetti di queste citochine nel cervello impedisce l’espressione di certi sintomi del “sickness behavior”. Questi dati indicano il ruolo delle citochine pro-infiammatorie nel generare un “sickness behavior” durante patologie acute (Dantzer, 2004).
Lo studio del possibile ruolo delle citochine, prodotte nel sistema nervoso centrale, nella fisiologia del cervello e del loro contributo all’integrazione delle interazioni tra sistema immunitario e cervello a livello centrale è stato affrontato negli ultimi anni. Ci si è chiesto soprattutto se un aumento dell’attività neuronale in un cervello “sano” potesse influenzare la produzione locale di citochine. Una prova diretta deriva dalla dimostrazione che la stimolazione pre-sinaptica di definiti neuroni, come accade in condizioni fisiologiche, può controllare la produzione locale di citochine da parte delle cellule gliali e dei neuroni. Il potenziamento a lungo termine (LTP) dell’attività sinaptica nell’ippocampo è servita come modello per affrontare quest’argomento. Un chiaro aumento dell’espressione genica di IL-1Beta, innescata da neuroni glutaminergici attraverso recettori NMDA, è stato osservato in sezioni di ippocampo e in ratti liberi di muoversi nel corso di LTP (Schneider et al. 1998). Più recentemente, abbiamo osservato che il gene IL-6 è anche over-espresso in corso di LTP in vivo e in vitro (Balschun et al., 2004). Questi dati costituiscono la prima prova che l’espressione genica della citochina nel cervello può essere innescata da un indotto aumento pre-sinaptico dell’attività in una popolazione specifica di neuroni.
Gli autori dell’articolo e altri hanno studiato fino a che punto le citochine prodotte nel cervello durante LTP possano influenzare la plasticità e la performance delle sinapsi. A questo stadio, è necessario distinguere tra studi basati su una somministrazione esogena di citochine e studi focalizzati sugli effetti delle citochine prodotte endogenamente dalle cellule cerebrali. Esiste una vasta letteratura dimostrante che la somministrazione esogena di citochine in vivo ed in vitro può influenzare l’induzione di LTP e la plasticità delle sinapsi (vedi Besedovsky and del Rey, 1996). Questi studi, sebbene importanti dal punto di vista farmacologico, non possono dimostrare con affidabilità l’effetto delle citochine prodotte nel cervello in condizioni naturali. Infatti, il potenziamento a lungo termine è un fenomeno complesso che coinvolge un numero di recettori e mediatori che influenzano la sua inducibilità, il suo avviamento e il suo mantenimento in modi diversi.
In particolare, il mantenimento di LTP è dipendente dalla sintesi proteica e implica l’attivazione di geni in una data sequenza ed il rilascio dei loro prodotti in una certa quantità. Così, è quasi impossibile mimare l’effetto tempo-dipendente di una citochina prodotta endogenamente attraverso la sua somministrazione esogena. Per esempio, come sarà discusso in seguito, l’IL-1, una citochina che inibisce il potenziamento a lungo termine quando è somministrata esogenamente, contribuisce al consolidamento e al mantenimento di questo processo quando esso viene prodotto endogenamente. Usando lo specifico antagonista del recettore dell’IL-1 (IL-1ra), è stato scoperto che il blocco dei recettori IL-1, sia in vivo che in sezioni di ippocampo, dà luogo all’inibizione del mantenimento di LTP.
Quest’effetto è reversibile e avviene solo quando l’antagonista viene somministrato dopo che il potenziamento è innescato, cioè in un momento in cui, secondo gli studi già menzionati, ci si aspettano aumentati livelli di IL-1. Studi nei topi knock out per il recettore di tipo 1 dell’IL-1 sono in linea con queste scoperte (Avital et al., 2003). E’ stato recentemente scoperto che, in contrasto con l’effetto di supporto di IL-1, IL-6 contribuisce alla cessazione di LTP ben consolidato (Balschun et al., 2004). Nel complesso, questi risultati suggeriscono fortemente che IL-1Beta e IL-6 possono controllare il mantenimento dell’LTP nel cervello, un processo a cui è assegnato un ruolo nella formazione della memoria e in alcuni tipi di apprendimento. Inoltre, questi studi forniscono la prova del ruolo fisiologico e neuro-modulatore delle citochine originalmente descritte come mediatori immunitari.
Come nel caso del LTP, gli effetti della somministrazione di citochine sull’apprendimento, la memoria e il comportamento in generale, sono stati ampiamente studiati (vedi Anisman et al., 2005). Ancora una volta, questi studi sono indubbiamente di rilevanza farmacologica, ma non possono rispecchiare gli effetti fisiologici delle citochine, cosa che è il principale obiettivo di questo articolo. Così, di seguito saranno discussi i possibili effetti fisiologici delle citochine endogene sulla memoria e l’apprendimento. Come detto prima, un temporaneo blocco di IL-1 endogena nelle sezioni di ippocampo e nel cervello di ratti liberi di muoversi dà luogo all’inibizione del mantenimento del processo LTP. Considerando che è attualmente accettato che il processo LTP sia alla base di certe forme di memoria, è stato ipotizzato che tale processo sarebbe inibito in animali in cui gli effetti di IL-1 non possono essere visibili.
Questo è il caso dei topi knock out per il recettore IL-1 di tipo 1 (Yirmiya et al., 2002). Questi topi mostrano una più lunga fase di latenza a raggiungere una piattaforma nascosta, nella versione spaziale del test del labirinto ad acqua inoltre, mostrano una paura contestuale condizionata diminuita, ma si comportano allo stesso modo degli animali di controllo nei compiti di memoria ippocampo-indipendente. Il blocco dei recettori dell’IL-1 nel cervello di normali animali che eseguono un compito di apprendimento (il labirinto ad acqua di Morris) causa un handicap nella memoria ippocampo-dipendente. Questi risultati suggeriscono che il segnalamento dell’IL-1 all’interno dell’ippocampo gioca un ruolo critico nei processi di apprendimento e di memoria (Avital et al., 2003). E’ degno di nota il fatto che, negli studi precedentemente citati, il blocco del segnalamento di IL-1 è stato indotto dopo la procedura di training. D’altra parte, c’è la prova che il blocco prima del training degli effetti dell’IL-1 mediato da un vettore adenovirus esprimente l’antagonista IL-1ra, causa un miglioramento dei punteggi di conservazione della memoria sia a breve che a lungo termine (Depino et al., 2004). Comunque, come già detto, la IL-1 prodotta endogenamente nell’apprendimento contribuisce a memorizzare un preciso compito.
E’ stato anche studiato il ruolo dell’IL-6 endogenamente prodotta nel cervello. Come è già stato discusso, l’IL-6 viene prodotta durante il processo LTP. Il blocco di IL-6 endogena dopo l’apprendimento con alternanza spaziale ippocampo-dipendente ha dato luogo a significativi miglioramenti della memoria a lungo termine (Balschun et al., 2004). Inoltre, i topi knock-out per l’IL-6, nell’apprendimento al labirinto a raggi, si sono dimostrati facilitati per oltre 30 giorni per quanto riguarda un numero più basso di errori della memoria di lavoro (Braida et al., 2004).
Considerando questi risultati nel complesso, sembra chiaro che, pur avendo ruoli opposti, l’IL-1 e l’IL-6 endogene, prodotte nel cervello “sano”, sono importanti per il controllo della plasticità delle sinapsi e del processing della memoria nell’ippocampo. Il meccanismo che è alla base del ruolo dell’IL-1 e l’IL-6 in questi processi è ancora sconosciuto, ma dati recenti indicano il coinvolgimento di NFk-B, un fattore di trascrizione che media la produzione e gli effetti di citochine multiple (vedi Meffert and Baltimore, 2005).
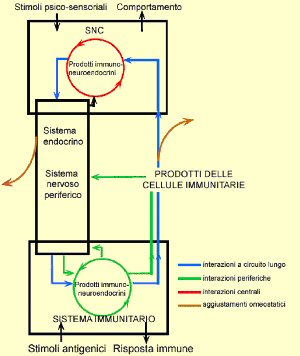
Concludendo, esistono esempi che le citochine prodotte in un cervello in buone condizioni possano contribuire alla fisiologia cerebrale controllando l’attività dei neuroni, influenzando così i sistemi di controllo neuro-endocrini, la messa a punto della regolazione dei meccanismi omeostatici essenziali e le funzioni intrinseche del sistema nervoso centrale, come la memoria e l’apprendimento. C’è anche la prova che le citochine prodotte nel cervello coordinano gli adattamenti fisiologici durante le malattie e le risposte immunoregolatrici neuro-endocrine (Fig. 1, cerchio rosso). Sembra che le citochine giochino un doppio ruolo nelle patologie del cervello; da una parte esse possono controllare la risposta immunitaria locale attraverso interazioni citochine-neuroni e dall’altra si possono comportare come mediatori effettori in grado di contribuire alla patologia.
5. 2007: ASPETTANDO L’INIZIO
Questo sottotitolo è chiaramente ottimistico, dato che ha la presunzione di sottolineare la mole quasi infinita di lavoro lasciato alle nuove generazioni. Per esempio, spesso si è fatto riferimento alle risposte immunoregolatrici neuro-endocrine che vengono suscitate seguendo la stimolazione del sistema immunitario. Questa è un’eccessiva semplificazione che deriva dai modelli sperimentali usati inizialmente per portare alla luce delle interazioni immuno-neuro-endocrine. Non esiste “una” risposta immunitaria: ci sono probabilmente tanti tipi di risposte immunitarie quante sono le condizioni patologiche.
Mentre gli immunologi distinguono fra gli aspetti differenti dell’immunità naturale e il tipo della risposta immunitaria adattata, per esempio le risposteTh1/Th2-mediate, nelle condizioni reali l’immunità è basata su meccanismi incrociati che in molti casi sono il prodotto di un bilanciamento tra le cellule immunitarie e l’agente causale di una malattia, per esempio un microrganismo, e, perché no, l’intervento terapeutico usato. In ogni stadio di una malattia, vengono attivati meccanismi mediati da modelli molecolari patogeno-associati (PAMPs), vengono scoperte combinazioni particolari di cellule immunitarie e dei loro specifici prodotti e viene individuato un cocktail di altri mediatori nella circolazione e nei tessuti infiammati/infetti. Così, ci si aspetta che le risposte neuro-endocrine durante la malattia ed il loro risultato immunoregolatore siano differenti e che richiedano un esame a tutti i livelli. Inoltre oggi potremmo stabilire che le interazioni locali immuno-neuro-endocrine a ciclo breve potrebbero verosimilmente avvenire in tutti gli organi o tessuti sia in condizioni di salute che di malattia.
Nell’ultima decade, una svolta importante è derivata dall’esplorazione del complesso macchinario intracellulare implicato nella risposta di una cellula in seguito alla stimolazione di un dato recettore. Per esempio, le differenti proteine-chinasi, i secondi messaggeri, i fattori di trascrizione, gli eventi post-trascrizionali e i modulatori intra-cellulari possono diventare punti d’incontro durante l’attivazione simultanea o sequenziale dei recettori per mezzo di leganti di derivazione immunitaria e neuro-endocrina su cellule immunitarie e non-immunitarie. Questo darebbe luogo ad un potenziale sinergismo, o antagonismo, quasi infinito tra gli effetti di questi leganti in condizioni normali o patologiche. Comunque, dal punto di vista della Fisiologia, l’esame delle interazioni immuno-neuro-endocrine a livello cellulare non dovrebbe essere disgiunto dagli eventi omeostatici a monte che danno luogo a cambiamenti nella produzione e nella liberazione di diversi leganti ed all’espressione dei loro recettori sulla cellula bersaglio.
Oggi non suonerebbe esagerato affermare che quasi tutte le patologie hanno una componente infiammatoria/immunitaria che interagisce con i meccanismi nervosi ed endocrini. Infatti, le cellule immunitarie, in particolare le cellule dotate di antigeni, sono presenti in tutti i tessuti dove esse sono esposte ad ormoni e neuro-trasmettitori. Come è stato affermato nell’introduzione, è difficile trovare il limite tra situazioni fisiologiche e patologiche quando ci si riferisce al sistema immunitario. Gli autori si domandano se le diverse denominazioni date al campo siano in qualche modo restrizioni auto-imposte.
Per esempio, un campo di ricerca dedito allo studio della psico-neuro-immunologia delle malattie della pelle dovrebbe chiamarsi psico-neuro-immuno-dermatologia? Questo si dovrebbe applicare a tutte le specialità mediche ed anche alla Biologia (psico-neuro-immuno-biologia?) e si potrebbe continuare aggiungendo tutti i possibili acronimi della denominazione del nostro campo. Cosa stiamo realmente facendo quando studiamo le interazioni immuno-neuro-endocrine in ogni organo? Dal punto di vista degli autori, ciò che affrontano è un serio tentativo di integrare l’attuale conoscenza in biologia e in medicina, basata su un approccio multidisciplinare.
Questo tentativo serve a unire i dati ottenuti usando approcci sistemici con i dati derivati dalla realizzazione di tecnologie raffinate che permettono l’analisi di fenomeni a livello molecolare. Il lavoro presentato serve a ristabilire l’equilibrio tra deduzione e induzione, analisi e sintesi, cosa che è, in effetti, l’essenza della scienza. Il bisogno di ristabilire tale equilibrio deriva dall’attuale predominanza degli approcci analitici che talvolta degenerano in punti di vista riduttivi. Tale predominanza deriva probabilmente dagli immensi progressi tecnologici delle ultime decadi che danno luogo alla tentazione (talvolta favorita da enti di finanziamento e da giornali ad alto indice d’impatto) di investire risorse nello studio di meccanismi molecolari isolati dal loro significato fisiologico e pato-fisiologico. Senza dubbio, anche se tutti i prodotti che servono come messaggeri per la comunicazione intra-, extra- e inter-cellulare fossero identificati, non saremmo capaci di decifrare tutti i messaggi che essi potrebbero trasmettere. Un messaggero può essere purificato, ma non il messaggio che esso trasmette, messaggio che dipende da una grande varietà di condizioni spaziali e temporali e dalle condizioni attuali del bersaglio che riceve le informazioni. Così, la domanda è: è arrivato il momento per ri-denominare il nostro campo chiamandolo semplicemente “Biologia e Medicina Integrative”?
6. NOTE BIBLIOGRAFICHE
Ader, R., Cohen, N., 1975. Behaviorally conditioned immunosuppression. Psychosom. Med. 37, 333–340.
Anisman, H., Merali, Z., Poulter, M.O., Hayley, S., 2005. Cytokines as a precipitant of depressive illness: animal and human studies. Curr. Pharm. Des. 11, 963–972.
Avital, A., Goshen, I., Kamsler, A., Segal, M., Iverfeldt, K., Richter- Levin, G., Yirmiya, R., 2003. Impaired interleukin-1 signaling is associated with deficits in hippocampal memory processes and neural plasticity. Hippocampus 13, 826–834.
Balschun, D., Wetzel, W., Del Rey, A., Pitossi, F., Schneider, H., Zuschratter, W., Besedovsky, H.O., 2004. Interleukin-6: a cytokine to forget. FASEB J. 18, 1788–1790.
Besedovsky, H.O., del Rey, A., 1996. Immune–neuro–endocrine interactions: facts and hypotheses. Endocr. Rev. 17, 64–102.
Besedovsky, H.O., del Rey, A., 2006. Regulating inflammation by glucocorticoids. Nat. Immunol. 7, 537.
Besedovsky, H.O., del Rey, A., Sorkin, E., 1981. Lymphokine-containing supernatants from con A-stimulated cells increase corticosterone blood
levels. J. Immunol. 126, 385–387.
Besedovsky, H.O., del Rey, A., Sorkin, E., Da Prada, M., Burri, R., Honegger, C., 1983. The immune response evokes changes in brain noradrenergic neurons. Science 221, 564–566.
Besedovsky, H.O., del Rey, A., Sorkin, E., Dinarello, C.A., 1986. Immunoregulatory feedback between interleukin-1 and glucocorticoid hormones. Science 233, 652–654.
Besedovsky, H.O., Sorkin, E., 1977. Network of immune-neuroendocrine interactions. Clin. Exp. Immunol. 27, 1–12.
Blalock, J.E., Harbour-McMenamin, D., Smith, E.M., 1985. Peptide hormones shared by the neuroendocrine and immunologic systems. J. Immunol. 135, 858s–861s.
Braida, D., Sacerdote, P., Panerai, A.E., Bianchi, M., Aloisi, A.M., Iosue, S., Sala, M., 2004. Cognitive function in young and adult IL (interleukin)-6 deficient mice. Behav. Brain. Res. 153, 423–429.
Dantzer, R., 2004. Cytokine-induced sickness behaviour: a neuroimmune response to activation of innate immunity. Eur. J. Pharmacol. 500, 399–411.
del Rey, A., Besedovsky, H., 1989. Antidiabetic effects of interleukin 1. Proc. Natl. Acad. Sci. USA 86, 5943–5947.
del Rey, A., Besedovsky, H.O., 1992. Metabolic and neuroendocrine effects of pro-inflammatory cytokines. Eur. J. Clin. Invest. 22 (Suppl. 1), 10–15.
del Rey, A., Kabiersch, A., Petzoldt, S., Besedovsky, H.O., 2002. Involvement of noradrenergic nerves in the activation and clonal deletion of T cells stimulated by superantigen in vivo. J. Neuroimmunol. 127, 44–53.
del Rey, A., Monge-Arditi, G., Besedovsky, H.O., 1998. Central and peripheral mechanisms contribute to the hypoglycemia induced by interleukin-1. Ann. N. Y. Acad. Sci. 840, 153–161.
del Rey, A., Roggero, E., Kabiersch, A., Schafer, M., Besedovsky, H.O., 2006. The role of noradrenergic nerves in the development of the lymphoproliferative disease in Fas-deficient, lpr/lpr mice. J. Immunol. 176, 7079–7086.
Delgado, M., Pozo, D., Ganea, D., 2004. The significance of vasoactive intestinal peptide in immunomodulation. Pharmacol. Rev. 56, 249–290.
Depino, A.M., Alonso, M., Ferrari, C., del Rey, A., Anthony, D., Besedovsky, H., Medina, J.H., Pitossi, F., 2004. Learning modulation by endogenous hippocampal IL-1: blockade of endogenous IL-1 facilitates memory formation. Hippocampus 14, 526–535.
Elenkov, I.J., Wilder, R.L., Chrousos, G.P., Vizi, E.S., 2000. The sympathetic nerve—an integrative interface between two supersystems: the brain and the immune system. Pharmacol. Rev. 52, 595–638.
Heijnen, C.J., Kavelaars, A., 1999. The importance of being receptive. J. Neuroimmunol. 100, 197–202.
Jessop, D.S., 2002. Neuropeptides: modulators of immune responses in health and disease. Int. Rev. Neurobiol. 52, 67–91.
Kent, S., Bluthe, R.M., Dantzer, R., Hardwick, A.J., Kelley, K.W., Rothwell, N.J., Vannice, J.L., 1992. Different receptor mechanisms mediate the pyrogenic and behavioral effects of interleukin 1. Proc. Natl. Acad. Sci. USA 89, 9117–9120.
Maier, S.F., Goehler, L.E., Fleshner, M., Watkins, L.R., 1998. The role of the vagus nerve in cytokine-to-brain communication. Ann. N. Y. Acad. Sci. 840, 289–300.
Meffert, M.K., Baltimore, D., 2005. Physiological functions for brain NFkappaB. Trends Neurosci. 28, 37–43.
Nussdorfer, G.G., Malendowicz, L.K., 1998. Role of VIP, PACAP, and related peptides in the regulation of the hypothalamo–pituitary– adrenal axis. Peptides 19, 1443–1467.
Obal Jr., F., Krueger, J.M., 2003. Biochemical regulation of non-rapideye- movement sleep. Front. Biosci. 8, d520–d550.
Pitossi, F., del Rey, A., Kabiersch, A., Besedovsky, H., 1997. Induction of cytokine transcripts in the central nervous system and pituitary following peripheral administration of endotoxin to mice. J. Neurosci. Res. 48, 287–298.
Rogausch, H., del Rey, A., Kabiersch, A., Reschke, W., Ortel, J., Besedovsky, H., 1997. Endotoxin impedes vasoconstriction in the spleen: role of endogenous interleukin-1 and sympathetic innervation. Am. J. Physiol. 272, R2048–R2054.
Sanders, V.M., 2006. Interdisciplinary research: noradrenergic regulation of adaptive immunity. Brain Behav. Immun. 20, 1–8.
Schauenstein, K., Fassler, R., Dietrich, H., Schwarz, S., Kromer, G., Wick, G., 1987. Disturbed immune–endocrine communication in autoimmune disease. Lack of corticosterone response to immune signals in obese strain chickens with spontaneous autoimmune thyroiditis. J. Immunol. 139, 1830–1833.
Schneider, H., Pitossi, F., Balschun, D., Wagner, A., del Rey, A., Besedovsky, H.O., 1998. A neuromodulatory role of interleukin- 1beta in the hippocampus. Proc. Natl. Acad. Sci. USA 95, 7778– 7783.
Sternberg, E.M., 2006. Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens. Nat. Rev. Immunol. 6, 318–328.
Sternberg, E.M., Hill, J.M., Chrousos, G.P., Kamilaris, T., Listwak, S.J., Gold, P.W., Wilder, R.L., 1989. Inflammatory mediator-induced hypothalamic–pituitary–adrenal axis activation is defective in streptococcal cell wall arthritis-susceptible Lewis rats. Proc. Natl. Acad. Sci.USA 86, 2374–2378.
Tracey, K.J., 2002. The inflammatory reflex. Nature 420, 853–859.
Turnbull, A.V., Rivier, C.L., 1999. Regulation of the hypothalamic– pituitary–adrenal axis by cytokines: actions and mechanisms of action. Physiol. Rev. 79, 1–71.
Weihe, E., Nohr, D., Michel, S., Muller, S., Zentel, H.J., Fink, T., Krekel, J., 1991. Molecular anatomy of the neuro–immune connection. Int. J. Neurosci. 59, 1–23.
Yirmiya, R., Winocur, G., Goshen, I., 2002. Brain interleukin-1 is involved in spatial memory and passive avoidance conditioning. Neurobiol. Learn Mem. 78, 379–389.