di Nicola Barsotti, D.O.
1. Introduzione al Morbo Di Crohn
Il Morbo di Crohn (MdC), definito anche Enterite Regionale, è un’infiammazione cronica intestinale di tipo transmurale (cioè coinvolge tutti e quattro gli strati della parete intestinale), recidivante, che può colpire qualsiasi sede del tratto gastrointestinale, dalla bocca all’ano, con distribuzione discontinua delle lesioni. Questa patologia rientra nella classificazione delle malattie intestinali croniche (IBD). La sua eziologia è sconosciuta ma, clinicamente, è caratterizzata da fasi di quiescenza di durata variabile (da alcune settimane a vari mesi) interrotte da episodi di riacutizzazione dovuti ad una alterata attivazione dell’immunità mucosale.
I dati epidemiologici ci dicono che il maggior numero dei casi si registrano principalmente nell’America del Nord, in Europa (circa 2.2 milioni, con maggior incidenza nei paesi del Nord) ed in Australia.
In Italia, purtroppo, abbiamo solo stime non ufficiali che ci dicono che questa patologia è in aumento (al momento si segnalano circa 200 mila casi). Inoltre, vasi studi hanno messo in evidenza come la diagnosi di MdC sia sempre più precoce: questa patologia, infatti, compare spesso negli adolescenti o nei giovani adulti e colpisce con una frequenza leggermente maggiore le donne.
Dal punto di vista clinico, il MdC può essere inquadrato in tre fenotipi clinici, in accordo con la Classificazione di Montreal (Silverberg 2005):
- Non Stenotizzante-Non Penetrante (81%, fenotipo B1)
- Stenotizzante (5%, fenotipo B2)
- Penetrante (fenotipo B3p, in tenue, colon, peri-anale)
2. Morbo di Crohn: anatomia patologica
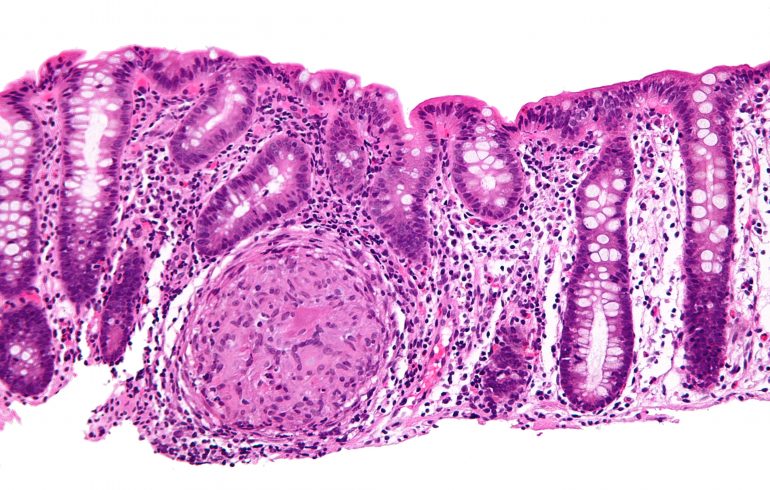
Gli studi di anatomia patologica hanno messo in evidenza la presenza di multiple aree di malattia, caratterizzate dal classico aspetto “a ciottolato”. Queste aree di lesione col tempo finiscono per unirsi tra loro, creando una serpentina di regioni ulcerate. Comunemente ritroviamo edema della mucosa che nel tempo porta alla perdita delle normali pliche intestinali.
Nelle fasi precoci del processo infiammatorio le lesioni sono rappresentate da ascessi criptici e ulcere aftoidi. Il cronicizzare dell’infiammazione, invece, porta alla formazione dei granulomi a cellule epitelioidi e cellule giganti. A fianco di ciò ritroviamo aggregati linfoidi della sottomucosa, abbondante infiltrato di linfociti e monociti nella lamina propria e fissurazioni della mucosa.
Queste alterazioni microscopiche si traducono, sul piano macroscopico in una serie di ulcere aftoidi, dapprima piccole e superficiali, poi confluenti in modo da delimitare aree di mucosa risparmiata dal processo flogistico.
Si genera in questo modo il così detto “aspetto a ciottolato”. A livello microscopico, durante la fase attiva del MdC, si ritrovano abbondanti neutrofili che infiltrano e danneggiano l’epitelio (Rugarli et al. 2012).
3. Morbo di Crohn: manifestazioni cliniche
Le manifestazioni cliniche di questa malattia sono estremamente variabili. I sintomi più frequenti in fase iniziale sono attacchi intermittenti di diarrea, febbre e dolore addominale. In alcuni casi possiamo ritrovare sangue nelle feci. I sintomi cardinali, comunque, sono (Melmed e Targan 2016):
- Diarrea (70-90%)
- Dolore addominale (45-65%) frequente e persistente
- Calo ponderale (65-75%)
I sintomi di accompagnamento, invece, sono: astenia, anoressia, nausea, vomito e febbre.
Va sottolineato il fatto che la fase attiva della malattia può essere favorita da fattori esterni come lo stress emotivo o fisico, l’alimentazione scorretta e/o il fumo di sigaretta.
I pazienti possono presentare anemia da carenza di ferro, perdita di proteine del siero e ipoalbuminemia, malassorbimento generalizzato o carenza di vitamina B12.
Le complicanze possono essere gli ascessi (intra parietali, intra addominali o più spesso perianali), tragitti fistolosi (che possono mettere in connessione due anse o addirittura aprirsi in altri organi come vescica, vagina, o anche all’esterno) e restringimenti stenotici (dovuti alla progressiva fibrotizzazione della parete intestinale, con il conseguente sviluppo di dilatazioni pre-stenotiche).
L’ulcerazione è comune nel morbo di Crohn e ripetuti cicli di distruzione e rigenerazione delle cripte portano ad una distorsione dell’architettura della mucosa.
Il MdC, inoltre, può presentare complicanze extra-intestinali e sistemiche che si presentano nel 20-25% dei pazienti e possono influenzare la morbilità e la mortalità.
Gli organi coinvolti più frequentemente sono la pelle (principalmente eritema nodoso e pioderma gangrenoso), le articolazioni (periferiche ma anche sacro-iliache nel 29% dei casi), il tratto biliare (calcolosi biliare, steatosi epatica e iper-transaminasemia) e gli occhi (soprattutto episclerite e uveite) (Monsen 1990). Inoltre, nel pazienti con MdC, è abbastanza frequente la presenza di calcoli urinari di ossalato.
4. Patogenesi del Morbo di Crohn
Per ciò che concerne la patogenesi, come abbiamo già detto, è sconosciuta, anche se i ricercatori sostengono che essa abbia un’origine multifattoriale, in cui si intersecano fattori ambientali con quelli genetici. Di base comunque, è stata documentata un’infiammazione diffusa della mucosa intestinale associata ad una disregolazione del sistema immunitario della mucosa in grado di provocare una risposta inappropriata verso gli antigeni innocui presenti nel lume intestinale.
Tutto questo si manifesta in individui geneticamente predisposti ed esposti ad uno o più fattori scatenanti ambientali. Nel tempo, l’infiammazione cronica provoca una distruzione tissutale ed una riduzione della funzione degli organi colpiti, con conseguente disabilità e morte.
Sempre in relazione all’infiammazione, nei pazienti con MdC è stato riscontrato un aumento di citochine pro-infiammatorie nella parete intestinale (nello specifico TNF, IFN-gamma, IL-1, IL-2, IL-6 e IL-12) (Noguchi et al. 1998) accompagnato anche ad aumento di fattori anti-infiammatori (IL-10 e IL-1ra) che comunque risultano insufficienti per il controllo della flogosi (Autschbach et al. 1998, Andreakos et al. 2002).
La sproporzionata infiammazione intestinale verso gli antigeni innocui non si limita a distruggere l’intestino. Le citochine infiammatorie rilasciate, infatti, sia attraverso la circolazione sanguigna che, tramite le terminazioni nervose (un ruolo centrale viene giocato dal nervo vago), giungono al sistema nervoso centrale (SNC) provocando infiammazione anche nel cervello. Nel tempo, questa flogosi centrale determina modificazioni comportamentali e si manifestano sintomi come ansia, attacchi di panico, depressione, etc. (Chiera et al. 2017).
4.1. Patogenesi: il ruolo del microbiota
Nel nostro intestino è presente una numerosa popolazione batterica, chiamata Microbiota Intestinale, che conta tra 10 alla 13ª e 10 alla 14ª organismi/ml di materiale fecale (il 50% della massa fecale) e che è soggetta a una significativa variazione individuale nella sua composizione, potendo essere modificata dalla dieta e dalla malattia (Power 2013). Si è visto che i pazienti con IBD possiedono una disbiosi del microbiota intestinale, con una riduzione della diversità di questa comunità batterica rispetto agli individui sani.
I metaboliti del microbiota presenti nel lume intestinale vengono avvertiti da particolari cellule dendritiche che attivano i linfociti T Helper. La disbiosi intestinale presente nei pazienti affetti da MdC fa sì che i suddetti linfociti attivino le risposte Th2 e/o Th17, cioè le risposte che provocano l’infiammazione incontrollata.
Il microbiota, l’intestino e il cervello, come abbiamo già accennato, comunicano attraverso il nervo vago, che è in grado di percepire i metaboliti del microbiota e le citochine proinfiammatorie rilasciate in loco dalle cellule immunitarie. La registrazione di queste informazioni, tramite il vago, viene trasferita al SNC, dove viene integrata nel network centrale autonomo per elaborare una risposta, sempre principalmente tramite il vago, che potrà essere adeguata o inappropriata.
Questo nervo, infatti, è in grado di rilasciare molecole anti-infiammatorie che contribuiscono a ridurre l’infiammazione intestinale. Ecco perchè è importante, in questi pazienti, che ci sia un buon equilibrio del Sistema Nervoso Autonomo (SNA) (Bottaccioli e Bottaccioli 2016).
E’ molto importante evidenziare che i pazienti con IBD presentano un tono vagale basso, con conseguente incremento dell’infiammazione periferica. A ciò va aggiunto che lo stress, molto presente in questi pazienti, inibisce l’attività vagale, aumentando gli effetti deleteri sul tratto gastrointestinale e sul microbiota (da qui l’importanza di avere un approccio sistemico a questa patologia e valutare anche lo stato emotivo dei pazienti) (Chiera et al. 2017).
Queste connessioni mettono in luce come la stimolazione del nervo vago, che ha proprietà anti-infiammatorie, possa essere un valido aiuto per favorire il ripristino dell’omeostasi nell’asse microbiota-intestino-cervello (Bonaz 2018).
4.2. Patogenesi: il ruolo del Sistema Nervoso Enterico
La presenza di disfunzioni del Sistema Nervoso Enterico (SNE) potrebbe giocare un ruolo molto importante, se non primario, nella patogenesi delle IBD, causando importanti ripercussioni sulla fisiologia del tratto intestinale. Il SNE viene considerato parte del SNA insieme alle componenti Parasimpatica e Ortosimpatica, con cui si rapporta, e comprende circa 600 milioni di neuroni che si localizzano negli strati della parete intestinale formando i plessi mienterico e sottomucoso (Furness 2003). Le terminazioni nervose del SNE entrano in contatto con le cellule immunitarie presenti in loco (Furness 2000).
Le principali caratteristiche del SNE sono:
- La capacità di funzionare indipendentemente dal SNC (Gershon 1999)
- La presenza al suo interno di neuroni afferenti, interneuroni e neuroni efferenti
- La Capacità di rilasciare oltre 30 differenti neurotrasmettitori.
Dal punto di vista funzionale, il SNE regola la motilità intestinale, il trasporto di fluidi ed elettroliti, la secrezione della mucosa, la produzione di citochine e la regolazione della funzionalità della barriera epiteliale. In pratica, tutte funzioni che risultano alterate nelle IBD (Taylor 2007).
Inoltre, nei pazienti affetti da MdC, sono state riscontrate:
– alterazioni nel numero e nella grandezza delle cellule neuronali enteriche e delle loro fibre;
– alterazioni delle cellule gliali intestinali (sono simili agli astrociti cerebrali: la loro funzione non è chiara, ma sembra che possano favorire la rigenerazione neurale per il mantenimento della funzione intestinale) (Cornet 2001, Ruhl 2004);
– variazioni dei livelli di neurotrasmettitori (Schneider 2001);
– variazioni nella funzionalità dei neurotrasmettitori correlate in maniera diretta alle variazioni della motilità intestinale, del tono vasomotore e del trasporto di fluidi ed elettroliti (Smith 2005, Mourad 2006).
Le problematiche appena elencate, da sole, non sembrano sufficienti per avviare la patologia infiammatoria cronica. Sembra infatti che sia necessario un fattore scatenante ambientale. Questo potrebbe spiegare perché le IBD stiano aumentando nelle popolazioni asiatiche e africane (adozione di uno stile di vita sempre più Occidentale) (Danese 2004).
4.3. Patogenesi: il ruolo del SNA
Nei pazienti con MdC vengono frequentemente riscontrate disfunzioni del SNA in associazione alla malattia intestinale.
La maggior parte degli studi, infatti, concorda nell’affermare che il MdC si associa molto spesso a disfunzioni della componente ortosimpatica del SNA (Sharma et al. 2009, Ohlsson et al. 2007).
Altri studi su pazienti con MdC hanno messo in evidenza una perdita di fibre ortosimpatiche in tutti gli strati della parete intestinale a cui si associa una proliferazione delle fibre che rilasciano sostanza P, soprattutto nelle tonache mucosa e muscolare dell’intestino.
Un altro modo in cui il SNA potrebbe facilitare la comparsa di patologie infiammatorie è dato dal fatto che l’acetilcolina rilasciata dalle terminazioni vagali, se da una parte inibisce il rilascio di citochine pro-infiammatorie da parte dei macrofagi, dall’altra potenzia l’endocitosi e la fagocitosi dei macrofagi peritoneali. Infatti, la stimolazione elettrica del vago nei topi determina un aumento del trasporto epiteliale e dell’uptake dei batteri del lume da parte dei macrofagi della lamina propria.
Pertanto, la capacità del nervo vago di aumentare la permeabilità della mucosa potrebbe facilitare il contatto di queste cellule con gli antigeni batterici presenti nel lume (Van Der Zanden 2009).
Infine, sempre in relazione ai fattori scatenanti il MdC e SNA, è necessario mettere in evidenza un fattore patogenetico fondamentale: l’infiammazione neurogenica.
È ormai noto infatti che le fibre nervose afferenti, in particolare le fibre nocicettive di tipo C, sono in grado di rilasciare alla periferia sostanze pro-infiammatorie in seguito alla loro stimolazione.
Oggi sappiamo che questi mediatori agiscono potenziando non solo i fenomeni vascolari tipici dell’infiammazione, ma anche l’attività delle cellule dell’immunità innata, come mastociti e cellule dendritiche, e di quella acquisita, come i linfociti T (Ding 2008, Mikami 2011).
Durante un’infiammazione acuta questo fenomeno è protettivo poiché facilita i processi fisiologici di guarigione delle lesioni e di difesa contro i patogeni.
Di contro, nelle patologie infiammatorie croniche, autoimmuni e allergiche, questa situazione amplifica le risposte immunitarie facilitando così il mantenimento dello stato infiammatorio (Engel 2011, Ostrowski 2011).
Inoltre, è stato di mostrato che il meccanismo dell’infiammazione neurogena, in una patologia cronica intestinale, non solo mantiene l’infiammazione periferica, come abbiamo appena detto, ma provoca la morte dei neuroni coinvolti nella regolazione dell’infiammazione stessa.
4.4. Patogenesi: i fibroblasti sotto stimolo immunitario e nervoso
Nei plessi del SNE i neuroni non sono in continuità. Le loro diramazioni infatti, non si toccano. Ogni cellula è avvolta da una guaina di tessuto connettivo, ed è proprio questa guaina che permette alle cellule nervose contigue di rapportarsi tra loro. Ne consegue quindi, che la comunicazione tra le cellule del SNE è mediata dalla fascia (Chiera et al. 2017).
Le aderenze, provocate anche da infiammazione cronica, possono pertanto modificare il funzionamento di queste strutture. Tali alterazioni del SNE che colpiscono i ritmi motori delle unità viscerali (insieme di organo-fascia-plesso mioenterico), possono essere provocate anche da disfunzioni apparato digerente come la stipsi, il gonfiore, il reflusso, la gastrite e la colite.
Inoltre, lo stato di infiammazione cronica trasforma il fibroblasto in miofibroblasto, cioè in una cellula con proprietà contrattili. Quando ciò si realizza, si genera una fibrotizzazione locale e, viste le suddette relazioni tra fascia e cellule del SNE, si verifica una stimolazione meccanica dei neuroni con conseguente aumento del rilascio di neurotrasmettitori proinfiammatori.
Si instaura così un circolo vizioso in cui struttura e funzione si condizionano l’una con l’altra, aumentando il danno locale (Barsotti et al. 2018).
4.5. Patogenesi: altri fattori
L’alimentazione viene considerata un fattore di rischio.
Un eccessivo consumo di zuccheri raffinati e di grassi saturi (Chapman-Kiddell 2010, Ananthakrishnan 2014) e un ridotto consumo di frutta e verdura (Amre 2007), favoriscono la comparsa del MdC o il suo aggravamento clinico.
Anche l’appendicectomia e il fumo di sigaretta si sono dimostrati fattori di rischio per lo sviluppo di questa patologia (Andersson 2003).
Alcuni studi suggeriscono l’associazione tra IBD e infezione da Salmonella o Campylobacter (Gradel 2009), Mycobacterium Paratuberculosis (Feller 2007) e gastroenteriti virali o batteriche (Porter 2008, Garcia Rodriguez 2006). Altri fattori di rischio sono l’eccessiva igiene (Strachan 1989) e l’uso di contraccettivi orali (Khalili 2013).
4.6. Patogenesi: le relazioni con i disturbi psichiatrici
In precedenza abbiamo messo in evidenza come l’asse intestino-cervello favorisca la comparsa di disturbi dell’umore come la depressione e l’ansia. Tale asse però è bidirezionale.
Ne consegue che gli stressors psicologici modulano la composizione e la biomassa totale del microbiota intestinale (Tahcè et al. 2004).
I pazienti affetti da MdC presentano scarsa tolleranza allo stress con conseguenti modificazioni della mobilità intestinale, alterazioni delle secrezioni della mucosa e della sensibilità viscerale, cambiamenti della permeabilità e delle risposte infiammatorie locali.
Lo stress infatti attiva i mastociti presenti nella mucosa intestinale e ciò induce iper-permeabilità della mucosa e un aumento delle citochine pro-infiammatorie (Tachè et al. 2007).
Inoltre, il rilascio delle catecolamine provocato dall’attivazione dell’asse dello stress, stimola direttamente la crescita dei batteri a livello intestinale: sui batteri infatti sono presenti recettori per neurotrasmettitori e per altre sostanze secrete sia dal SNE che dalle cellule del sistema immunitario (Lyte et al. 2011).
5. Terapia del Morbo di Crohn: dall’approccio farmacologico alle terapie complementari
Il trattamento del MdC ha lo scopo di raggiungere la remissione della patologia, sia dal punto di vista clinico che endoscopico (guarigione della mucosa), di interrompere il naturale corso della patologia (distruzione progressiva delle pareti del tratto digerente) e di prevenire e trattare le complicanze della patologia (Baert 2010).
Per ottenere questo, è necessario che alla terapia farmacologica si aggiunga, se necessario, un cambiamento dello stile di vita.
I pazienti con MdC, infatti, devono smettere di fumare e devono gestire al meglio l’alimentazione, cercando di correggere le carenze nutrizionali determinate dalla patologia (Dignass 2010).
Di recente sono stati fatti studi sul trapianto fecale in pazienti con MdC che hanno dato risultati incoraggianti.
La terapia farmacologica punta a diminuire l’infiammazione attraverso la somministrazione di farmaci immunosoppressivi, come quelli steroidei, le tiopurine, il metotrexato, gli inibitori del TNF (la loro assunzione però aumenta il rischio di sviluppare infezioni opportunistiche e, se usati a lungo, di sclerosi multipla – Mandel 2014), gli antibiotici (Nitzan 2016) e/o gli anticorpi monoclonali.
Questi ultimi si stanno sempre più affermando poichè diminuiscono la flogosi intestinale e permettono la guarigione della mucosa nel 70-85% dei casi (Mandel 2014). Il loro utilizzo, però, può favorire la comparsa di effetti avversi, a volte anche gravi: rash cutaneo, shock anafilattico o linfoma.
Inoltre, alcune persone non sono responsive alla terapia mentre altre vanno incontro ad una perdita secondaria di efficacia (Ding 2016).
Per ciò che concerne gli inibitori del TNF, come l’infliximab, l’adalimumab, il certolizumab ed il golimumab, come abbiamo già accennato, favoriscono il rischio di sviluppare infezioni opportunistiche (Ramiro 2014).
La somministrazione costante di questi farmaci, attraverso meccanismi a feedback, determina una riduzione di IL-10, con conseguente aumento dei livelli di IL-12 e IFN- gamma e conseguente aumento del rischio di demielinizzazione delle fibre nervose e possibilità di sviluppare patologie come la sclerosi multipla (Kaltsonoudis 2014).
Inoltre, sebbene le terapie anti-citochiniche diminuiscano efficacemente la risposta infiammatoria, non hanno un ruolo determinante nell’indurre la risoluzione permanente della malattia.
Ciò è dovuto al fatto che le citochine sono centrali nella fase infiammatoria, ma non riescono ad avere un’azione efficace nella guarigione tissutale e nella risoluzione dell’infiammazione. Infatti, un’azione anti-infiammatoria è diversa da un’azione risolutiva e riparatrice che coinvolge cellule e mediatori diversi.
A fianco di terapie anti-infiammatorie si dovrebbero quindi studiare terapie “pro-risoluzione” capaci di determinare il ripristino di una buona omeostasi (Nathan 2010).
L’approccio chirurgico nel MdC è indicato in presenza di ascessi, di fistole (perianali o interne) non responsive alla terapia farmacologica, di restringimenti fibro-stenotici con sintomi ostruttivi parziali o completi, di displasia grave e cancro (Larson 2004).
5.1. Medicine Complementari e osteopatia
I dati presenti in letteratura ci dicono che molti pazienti con IBD ricorrono all’uso delle medicine complementari (CAM) (Opheim 2012, Fernàndez 2012).
Tra queste, l’agopuntura e l’omeopatia sono quelle più utilizzate, mentre l’osteopatia non viene quasi mai riportata.
Uno studio italiano (Bertomoro 2010) infatti, mette in luce che l’osteopatia viene scelta da circa il 2-8% dei soggetti con IBD che si affidano alle CAM.
In riferimento all’osteopatia, in letteratura abbiamo pochi studi riguardanti la sua efficacia nel MdC, e quelli presenti sono di scarsa qualità. Sembra però che l’osteopatia possa ridurre sintomi come il colon irritabile (disturbo presente anche durante i periodi non sintomatici o di remissione della malattia). In particolare, si è notata una riduzione del dolore addominale e dell’astenia, in associazione a un miglioramento della qualità di vita (Piche 2014). Un altro studio, presentato al congresso europeo del MdC nel 2015, ma non pubblicato (Orofino 2015), ha riportato un miglioramento della qualità di vita nei pazienti sottoposti a una tecnica osteopatica rivolta alla radice del mesentere. In letteratura esiste anche un case-report pubblicato sull’AAO Journal (Mitchell 2006) ma la qualità del lavoro, che mette in luce il miglioramento della sintomatologia del pazienti con MdC, è veramente di basso livello.
Da quanto abbiamo potuto verificare, pertanto, i pochi studi presenti in letteratura hanno valutato esclusivamente la componente sintomatica e la qualità di vita dei pazienti con MdC.
Non abbiamo trovato lavori scientifici che abbiano misurato parametri oggettivi come l’HRV o i livelli delle citochine plasmatiche.
5.2. La stimolazione vagale come terapia complimentare nella gestione dei pazienti con MdC
Abbiamo visto che l’attività efferente del nervo vago è in grado di inibire le risposte infiammatorie attraverso il rilascio del neurotrasmettitore acetilcolina.
Questa particolare funzione del nervo vago è stata chiamata “via anti-infiammatoria colinergica” (CAP).
Il CAP, insieme all’asse dello stress (ipotalamo-ipofisi-surrene, in sigla HPA) sono le principali vie di regolazione interna e lavorano sinergicamente per modulare la risposta infiammatoria nelle infezioni e nei traumi (Chiera et al. 2017).
Il ramo afferente del vago percepisce l’ambiente interno periferico e in particolare la presenza di citochine infiammatorie rilasciate in un una determinata area del corpo: a questo punto il vago informa il cervello su ciò che sta accadendo in periferia, permettendogli di attivare le risposte per il mantenimento di una corretta fisiologia (innalzamento della temperatura corporea, attivazione dell’asse HPA e del sistema nervoso ortosimpatico, controllo della sintesi citochinica).
Nel riflesso vago-vagale del CAP, le fibre sensoriali arrivano al nucleo del tratto solitario (NTS), il quale si collega al nucleo motore dorsale e al nucleo ambiguo, aree di origine del vago efferente.
E’ necessario mettere in evidenza che il NTS ha connessioni dirette e indirette con molte altre aree cerebrali, compresi i nuclei ipotalamici che regolano l’asse HPA e il sistema nervoso ortosimpatico.
Le risposte vagali, perciò, sono molto complesse: alla periferia seguono sia la catena ortosimpatica che quella vagale, mentre centralmente influenzano e regolano il SNC (Ibidem).
Le molecole mediatrici dell’infiammazione che attivano il ramo afferente del vago sono svariate. Abbiamo endotossine, prostaglandine, citochine infiammatorie etc. rilasciate durante le infezioni e le lesioni. Il ramo efferente de vago, rilasciando acetilcolina, blocca la secrezione di citochine infiammatorie da parte delle cellule immunitarie, diminuendo così la presenza di molecole flogistiche nell’ambiente.
La scoperta dell’effetto anti-infiammatorio del vago ha fatto sorgere nuove strategie terapeutiche in campo reumatologico poiché, come abbiamo visto in precedenza, quelle farmacologiche attuali presentano molti effetti collaterali.
La Federal Drug Administration infatti, ha approvato l’uso di un elettrodo da applicare intorno al nervo vago per il trattamento di varie patologie e, tra queste, il MdC (Boeckxstaens 2013).
Nello specifico, si è visto che la stimolazione vagale, in questi pazienti, porta ad un miglioramento clinico ed endoscopico, al ripristino dell’equilibrio dell’innervazione vagale dell’intestino, alla diminuzione del dolore digestivo percepito, ad una riduzione della proteina C reattiva nel sangue e della calprotectina fecale e ad una normalizzazione nei parametri dell’HRV. L’applicazione dell’elettrodo, però, può presentare vari effetti collaterali ed è difficilmente utilizzabile in pazienti in fase acuta poiché è necessaria un’anestesia e un intervento chirurgico.
Proprio per ovviare a queste difficoltà, sono stati fatti studi sull’efficacia dell’agopuntura poiché l’attivazione del CAP può avvenire anche per stimolazione sensoriale.
Ricercatori orientali e occidentali hanno dimostrato che specifici agopunti della testa, del collo e dell’orecchio (gli stessi manipolati dagli osteopati) attivano il vago proprio perché stimolano terminazioni nervose connesse con i rami di questo nervo.
Queste evidenze potrebbero permettere di sviluppare importanti aree di ricerca anche in campo osteopatico, soprattutto in relazione all’osteopatia craniale e ai suoi effetti sistemici. Comunque, sapendo che l’osteopatia agisce sul riequilibrio del SNA (effetto iperparasimpaticotonico e di desensitizzazione neurale in grado di ridurre il dolore e l’infiammazione sia localmente che a livello sistemico) e sul bilanciamento di vari parametri neuroendocrini e immunitari, sarebbe opportuno sviluppare la ricerca sui pazienti con MdCandando a ricercare parametri più oggettivi rispetto a quelli tutt’oggi presenti (Barsotti et al. 2018).
6. Morbo di Crohn e trattamento manipolativo osteopatico: presentazione dell’Outcome Research effettuato al Collegio Italiano di Osteopatia
Lo studio è stato eseguito da studenti di osteopatia, con esperienza pluriennale come fisioterapisti, iscritti al sesto anno presso il Collegio Italiano di Osteopatia. I pazienti, contattati tramite le onlus che supportano le persone affette da MdC, hanno compilato il questionario HBI (Harvey-Bradshaw Index, utilizzato per misurare l’attività clinica del MdC) ed SF36 (misura la qualità di vita e la salute percepita).
Successivamente è stata raccolta l’anamnesi ed è stata fatta una valutazione presso lo Stress Control Lab di Parma dove è stato misurata l’HRV (è un indice affidabile dello stato di salute e delle capacità adattive del paziente, utile nel monitorare la progressione della malattia considerando che l’infiammazione sistemica riduce l’HRV) in condizioni di stress durante un Tilt Test.
Al termine delle valutazioni sono state consegnate le provette per il campionamento del cortisolo salivare con le istruzioni su come effettuare la raccolta (i campioni sono stati presi in quattro fasi della giornata: subito dopo il risveglio, 30 minuti dopo il risveglio, prima di pranzo e prima di andare a letto la sera. La raccolta è stata effettuata prima dell’inizio dello studio e al termine del ciclo manipolativo).
Nel mese successivo sono stati eseguiti tre trattamenti osteopatici di un’ora ciascuno con cadenza settimanale.
Durante ogni seduta sono state compilate le schede CRF (derivate dall’Outpatient Osteopathic S.O.A.P. Form) per la valutazione delle disfunzioni somatiche (ICD-10 ICM Diagnosis Code M99.09-09) ed è stato eseguito un trattamento a “black box” (sono state trattate le disfunzioni riscontrate nei singoli pazienti con le tecniche che l’osteopata ha ritenuto necessarie).
Dopo una settimana dall’ultimo trattamento i pazienti hanno eseguito una seconda misurazione dell’HRV, hanno consegnato le provette per la misurazione del cortisolo salivare ed hanno compilato nuovamente i questionari HBI ed SF36.
Infine, a distanza di un mese, è stato eseguito un follow up somministrando il questionario HBI.
Sono stati arruolati per questo studio persone tra i 18 e i 65 anni con diagnosi di MdC localizzata nel colon e/o intestino tenue e sotto terapia farmacologica stabile e non modificata nei 3 mesi precedenti lo studio.
Sono stati esclusi i pazienti con celiachia, fistole entero-cutanee/pelviche o stenosi che abbiano subito interventi chirurgici addominali nelle 12 settimane precedenti lo studio o che abbiano subito resezione intestinale estensiva o vagotomia.
Su 20 pazienti contattati sono risultati reclutabili 9 persone con età media di 40 anni.
L’analisi statistica è stata effettuata su otto pazienti (uno è stato escluso) per i questionari e l’HRV e cinque per ciò che concerne i livelli di cortisolo. Durante il periodo di trattamento non vi sono state reazioni avverse al trattamento.
I risultati hanno evidenziato un miglioramento statisticamente significativo nelle scale di Salute generale e mentale e nella riduzione dell’HBI.
La riduzione dell’HBI si è dimostrata significativa anche nel follow-up ad un mese.
L’analisi sulle misurazioni dell’HRV, di contro, non ha mostrato dati statisticamente significativi ma hanno comunque evidenziato una maggior responsività del sistema nervoso ortosimpatico durante la fase di tilt test, con miglior ripresa del sistema nervoso parasimpatico dopo il periodo di riposo (miglior bilanciamento del SNA).
Infine, l’analisi statistica effettuata sul cortisolo salivare ha evidenziato un incremento statisticamente significativo del cortisolo misurato a 30 minuti dal risveglio. Questo potrebbe indicare una miglior variazione circadiana di questo ormone.
Riguardo la valutazione ed il trattamento osteopatico, alcune delle disfunzioni più importanti sono state riscontrate in aree potenzialmente importanti per la fisiologia del SNA e del tratto digerente:
- Area pelvica: sacro, coccige, pavimento pelvico;
- Area toracica: D2, D3, D5, D6, D11;
- Area lombare: L1 ed L2, pilastri del diaframma;
- Area cervicale: fascia cervicale profonda, OAE;
- Area addominale: intestino tenue, valvola ileo-cecale, radice del mesentere, fosse iliache, area sovra-pubica.
I limiti dello studio, chiaramente, sono dati dal limitato numero di partecipanti che aumentano il rischio di errore di I tipo. Riteniamo però che questi dati siano promettenti ed è quindi nostra intenzione proseguire lo studio per avere un campione più significativo e dati più certi.
Bibliografia
- Amre DK et al. (2007), Imbalances in dietary consumption of fatty acids, vegetables, and fruits are associated with risk for Crohn’s disease in children. In Am. J. Gastroenterol., 102:2016-2025.
- Ananthakrishnan AN et al. (2010), Impact of autonomic dysfunction on inflammatory bowel disease. In J Clin Gastroenterol., 44(4):272-9.
- Andersson RE et al. (2003), Appendectomy is followed by increased risk of Crohn’s disease. In Gastroenterology., 124: 40–46.
- Andreakos ET, Foxwell BM et al. (2002), Cytokines and anti-cytokine biologicals in autoimmunity: present and future. In Cytokine & Growth Factor Reviews., 13:299– 313.
- Autschbach F, Braunstein J et al. (1998), In situ expression of interleukin-10 in noninflamed human gut and in inflammatory bowel disease. In Am J Pathol., 153(1):121–30.
- Baert FJ, D’Haens GR et al. (1999), Tumor necrosis factor alpha antibody (infliximab) therapy profoundly down- regulates the inflammation in Crohn’s ileocolitis. In Gastroenterology, 116(1):22-8.
- Barsotti N. Et al. (2018). La PNEI e le discipline corporee. Edra S.p.A.
- Bertomoro P. Et al. (2010), Regional variations in the use of complementary and alternative medicines (CAM) for inflammatory bowel disease patients in Italy: an IG-IBD study. In J Crohns Colitis., 4(3):291-300.
- Boeckxstaens, G. (2013),The clinical importance of the anti-inflammatory vagovagal reflex, Handb Clin Neurol, 117 (11), pp. 119-34.
- Bonaz B, Sinniger V et al. (2016), Chronic vagus nerve stimulation in Crohn’s disease: a 6-month follow-up pilot study. In Neurogastroenterol Motil., 28(6):948-53.
- Bottaccioli F., Bottaccioli A.G. (2016), PsicoNeuroEndocrinoImmunologia e Scienza della Cura Integrata-Il Manuale. Edra S.p.A.
- Chapman-Kiddell CA, Davies PS et al. (2010), Role of diet in the development of inflammatory bowel disease. In Inflamm. Bowel Dis., 16: 137–151.
- Chiera M. Et al., (2017). La PNEI e in sistema miofasciale: la struttura che connette. Edra S.p.A.
- Cornet A., Savidge T.C et al. (2001), Enterocolitis induced by autoimmune targeting of enteric glial cells: a possible mechanism in Crohn’s disease? In Proc Natl Acad Sci U.S.A., 98, 13306-13311.
- Danese S, Sans M et al. (2004), Inflammatory bowel disease: the role of environmental factors. In Autoimmun. Rev., 3:394–400.
- Dignass A et al. (2010), European Crohn’s and Colitis Organisation (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: current management. In J Crohn’s Colitis., 4: 28–62.
- Ding W. Et al. (2008), Calcitonin gene-related peptide biases Langerhans cells toward Th2-type immunity. In J Immunol., 181:6020-6026.
- Engel M.A. et al. (2011), TRPA1 and substance P mediate colitis in mice. In Gastroenterology, 141:1346-1358.
- Feller M et al. (2007), Mycobacterium avium subspecies paratuberculosis and Crohn’s disease: a systematic review and meta-analysis. In Lancet Infect. Dis., 7:607–613.
- Fernández A, Barreiro-de Acosta M et al. (2012), Complementary and alternative medicine in inflammatory bowel disease patients: frequency and risk factors. In Dig Liver Dis., 44(11):904-8.
- Fritze D. et al. (2014), Thrombin mediates vagal apoptosis and dysfunction in inflammatory bowel disease. In J Gastrointest Surg., 18(8): 1495-1506.
- Furness J. B. (2000), Types of neurons in the enteric nervous system. In Journal of the Autonomic Nervous System, 81: 87–96.
- Furness J, Clerc Netal. (2003), The enteric nervous system and its extrinsic connections. In: Yamada T, Alpers D.N.K., (Eds.), Textbook of Gastroenterology. 4th. Lippincott, Williams and Wilkins, Philadelphia; 12-34.
- Garcia Rodriguez LA, Ruigomez A. et al. (2006), Acute gastroenteritis is followed by an increased risk of inflammatory bowel disease. In Gastroenterology, 130:1588–1594.
- Gershon M.D. (1999), The enteric nervous system: a second brain. In Hosp Pract., 34(7):31-52.
- Gradel K.O. et al. (2009), Increased short- and long-term risk of inflammatory bowel disease after salmonella or campylobacter gastroenteritis. In Gastroenterology, 137: 495–501.
- Kaltsonoudis E, Voulgari PV et al. (2014), Demyelination and other neurological adverse events after anti-TNF therapy. In Autoimmun. Rev., 13: 54-58.
- Khalili H et al. (2013), Oral contraceptives, reproductive factors and risk of inflammatory bowel disease. In Gut., 62: 1153–1159.
- Larson DW, Pemberton JH (2004), Current concepts and controversies in surgery for IBD. In Gastroenterology, 126: 1611–19.
- Lyte M, Vulchanova L. (2011), Stress at the intestinal surface: catecholamines and mucosa-bacteria interactions. In Cell Tissue Res., 343(1):23-32.
- Mandel MD, Miheller Petal. (2014), Have biologics changed thenatural history of Crohn’s disease? In Dig Dis., 32:351–359.
- Martin-De-Carpi J. Et al. (2013), Increasing incidence of pediatric inflammatory bowel disease n Spain (1996-2009): the SPIRIT registry. In Inflamm. Bowel Dis. 19(1): 73-80.
- Melmed GY, Targan S.R. (2016) Crohn’s Disease: Clinical Manifestations and Management, in Yamada’s Atlasof Gastroenterology (eds D. K. Et al.), John Wiley & Sons, Ltd, Oxford, UK.
- Mitchell D, Dickey J.L. (2006), Crohn’s Disease: A Case Report including the most recent Theories and Treatment Principles. In The AAO Journal., 22-25.
- Mikami N, et al. (2011), Calcitonin gene-related peptide is an important regulator of cutaneous immunity: effect on dendritic cell and T cell functions. In J Immunol., 186:6886–6893.
- Monsen U, Sorstad J et al. (1990), Extracolonic diagnose s in ulcerative colitis: An epidemiological study. In Am J Gastroenterol. 85:711-716.
- Morgan XC. et al. (2012), Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment. In Genome Biol., 13: R79.
- Mourad F. H., Barada K. A. et al. (2006), Inhibitory effect of experimental colitis on fluid absorption in rat jejunum: role of the enteric nervous system, VIP, and nitric oxide. In Am J Physiol Gastrointest Liver Physiol., 290, G262– G268.
- Nagalingam N.A., Lynch S.V. (2012), Role of the microbiota in inflammatory bowel diseases. In Inflamm. Bowel Dis., 18: 968–984.
- Nathan C and Ding A. (2010), Nonresolving inflammation. In Cell., 140(6):871-82.
- Nitzan O, Elias M, et al. (2016), Role of antibiotics for treatment of inflammatory bowel disease. In World J Gastroenterol., 22(3): 1078-1087.
- Noguchi M, Hiwatashi N et al. (1998), Secretion imbalance between tumor necrosis factor and its inhibitor in inflammatory bowel disease. In Gut, 43(2):203–9.
- Ohlsson B, Sundkvist G et al. (2007), Subclinical sympathetic neuropathy appears early in the course of Crohn’s disease. In BMC Gastroenterol., 7:33.
- Opheim R, Hoivik ML et al. (2012), Complementary and alternative medicine in patients with inflammatory bowel disease: the results of a population-based inception cohort study (IBSEN). In J Crohns Colitis., 6(3):345- 53.
- Orofino M., Grimaud J.C. et al. (2015), Osteopathy and improving the quality of life in crohn’s disease. Poster presentations: Clinical: Therapy & observation P610. 10th Congress of ECCO – European Crohn’s and Colitis Organisation.
- Ostrowski SM, Belkadi A et al. (2011), Cutaneous denervation of psoriasiform mouse skin improves acanthosis and inflammation in a sensory neuropeptide-dependent manner. In J Invest Dermatol., 131:1530–1538.
- Piche T, et al. (2014), Osteopathy decreases the severity of IBS-like symptoms associated with Crohn’s disease in patients in remission. Randomized controlled trial. Eur J Gastroenterol Hepatol. Dec;26(12):1392-8.
- Porter CK. et al. (2008), Infectious gastroenteritis and risk of developing inflammatory bowel disease. In Gastroenterology., 135:781–786.
- Power S.E. and O’Toole P.W. (2014), Intestinal microbiota, diet and health. In British Journal of Nutrition., 111:387– 402.
- Ramiro S, Gaujoux-Viala C et al. (2014), Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. In Ann. Rheum. Dis., 73: 529-535.
- Rugarli C, Cappio F, Cantalamessa L. (2012) Rugarli Medicina Interna Sistematica, 6° edizione. Elsevier.
- Ruhl A., Nasser Y. et al. (2004), Enteric glia. In Neurogastroenterol Motil., 16, 44–49.
- Sharma P., Makharia G.K. et al. (2009), Autonomic dysfunctions in patients with inflammatory bowel disease in clinical remission. In Dig Dis Sci., 54(4):853-61.
- Schneider J., Jehle E.C. et al. (2001), Neurotransmitter coding of enteric neurones in the submucous plexus is changed in non-inflamed rectum of patients with Crohn’s disease. In Neurogastroenterol. Motil., 13, 255–264.
- Silverberg MS, Satsangi J et al. (2005), Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. In Can J Gastroenterol. 2005, 19 (suppl A): 5–36.
- Smith A.S., Smid S.D. (2005), Impaired capsaicin and neurokinin-evoked colonic motility in inflammatory bowel disease. In J Gastroenterol Hepatol, 20, 697–704.
- Strachan D.P. (1989), Hay fever, hygiene, and household size. In BMJ, 299:1259–1260.
- Taché Y, Perdue MH et al. (2004), Role of peripheral CRF signalling pathways in stress-related alterations of gut motility and mucosal function. In Neurogastroenterol Motil., 1:137-42.
- Taché Y, Bonaz B et al. (2007), Corticotropin-releasing factor receptors and stress-related alterations of gut motor function. In J Clin Invest., 117(1):33-40.
- Taylor CT, Keely SJ et al. (2007), The autonomic nervous system and inflammatory bowel disease. In Auton Neurosci., 133(1):104-14.
- Van Der Zanden EP, Snoek SA et al. (2009), Vagus nerve activity augments intestinal macrophage phagocytosis via nicotinic acetylcholine receptor alpha4beta2. In Gastroenterology, 137(3):1029-39.